
研究NO2、、CO等大气污染气体的处理具有重要意义。
利用反应6NO2(g)+8NH3(g) 7N2(g)+12 H2O(g)可处理NO2。700℃时,向容积为2L的密闭容器中充入一定量的NO2和NH3, 反应过程中测定的部分数据见下表
7N2(g)+12 H2O(g)可处理NO2。700℃时,向容积为2L的密闭容器中充入一定量的NO2和NH3, 反应过程中测定的部分数据见下表
| 反应时间/min | n(NO2)/mol | n(NH3)/ mol |
| 0 | 1.20 | 1.60 |
| 2 | 0.90 | |
| 4 | | 0.40 |
科目:高中化学 来源: 题型:填空题
化学反应原理在科研和生产中有广泛应用。
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应:
TaS2(s)+2I2(g) TaI4(g)+S2(g) (Ⅰ)
TaI4(g)+S2(g) (Ⅰ)
某温度反应(Ⅰ)的K=4,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为 。
(2)如下图所示,反应(Ⅰ)在石英真空管中进行,先在温度高(T2)的一端放入未提纯的TaS2粉末和少量I2(g),加热一段时间后,在另一端温度低(T1)的一端得到了纯净的TaS2晶体,则该正反应的△H 0(填“>”或“<”),上述反应体系中循环使用的物质是 。
(3)上图为钠硫高能电池的结构示意图。该电池的工作温度为320℃左右,电池反应为2Na + xS=Na2Sx,正极的电极反应式为____________________________。M(由Na2O和Al2O3制得)的两个作用是________________________________________________和隔离钠与硫。
(4)写出Na2S溶液水解的离子方程式_______________________________________,Na2S溶液中c(H+)+ c(Na+)=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
二甲醚是一种重要的清洁燃料,可替代氟利昂作制冷剂,对臭氧层无破坏作用。工业上可利用水煤气合成二甲醚,其反应为:3H2(g)+3CO(g)  CH3OCH3(g)+CO2(g) ΔH<0
CH3OCH3(g)+CO2(g) ΔH<0
(1)在一定条件下的密闭容器中,该反应达到平衡后,只改变一个条件能同时提高反应速率和CO的转化率的是________(填字母代号,下同)。
a.降低温度 b.加入催化剂
c.缩小容器体积 d.减少CO2的浓度
(2)若反应在体积恒定的密闭容器中进行,下列能判断反应已达平衡状态的是________
a.3V正(CO2)=V逆(CO) b.生成a mol CO2的同时消耗3a mol H2
c.气体的密度不再改变 d.混合气体的平均相对分子质量不变
(3)300℃时,在体积为2L的容器中充入4 mol H2、6 mol CO。5min时,反应恰好达平衡,此时H2的转化率为75%。
① 5min时V(CO)=_________mol/(L·min)。该温度下,此反应的平衡常数为:_______
② 保持温度不变,在以上已达反应平衡的容器中,将每种物质同时增加1mol,则此时平衡将_______移动(填“正向”、“逆向”、“不”)
(4).下图中,甲装置为CH3OCH3、O2、KOH三者构成的燃烧电池,其电极均为Pt电极。装置乙中,C、D电极为Pb电极,其表面均覆盖着PbSO4,其电解液为稀H2SO4溶液。
① 写出甲装置中A极的电极反应式___________________________________________
② 写出乙装置中C极的电极反应式___________________________________________
③ 当有23克甲醚参加反应时,D电极的质量变化为______克。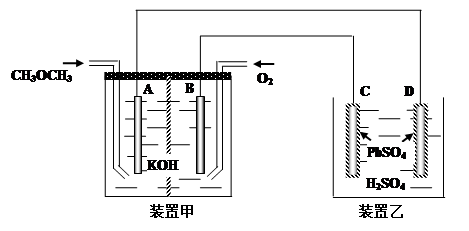
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知重铬酸钾(K2Cr2O7)是一种主要的的无机试剂。
(1)强氧化性的K2Cr2O7溶液中,存在如下平衡: Cr2O72-(橙色)+H2O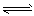 2CrO42-(黄色)+2H+,
2CrO42-(黄色)+2H+,
①若要使溶液的橙色加深,下列可采用的方法是 。
| A.加入适量稀盐酸 | B.加入适量稀硫酸 | C.加入适量烧碱固体 | D.加水稀释。 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有反应:mA(g)+ B(g) 2C(g),达到平衡后,当升高温度时,A的转化率变小;当减小压强时,混合体系中C的质量分数不变,则:
2C(g),达到平衡后,当升高温度时,A的转化率变小;当减小压强时,混合体系中C的质量分数不变,则:
(1)该反应的△H 0(填“>”或“<”),且m 1(填“>”“=”“<”)。
(2)若加入B(假设容器的体积不变),则A的转化率 ,B的转化率 。 (填“增大”“减小”或“不变”)
(3)若B是有色物质,A、C均无色,则加入C(假设容器的体积不变)时混合物颜色 ,而维持容器内压强不变,充入氖气时,混合物颜色 (填“变深”“变浅”或“不变”)。
(4)一定温度下,向1L密闭容器中加入1mol C(g)使其分解,气体A的物质的量随时间的变化如下图所示。则0~2 min内的平均反应速率υ(C)= 。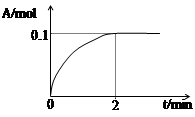
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某温度下,在密闭容器中SO2、O2、SO3三种气态物质建立化学平衡后,改变条件对反应2SO2(g)+O2(g)  2SO3(g),ΔH < 0的正、逆反应速率的影响如图所示:
2SO3(g),ΔH < 0的正、逆反应速率的影响如图所示:
(1)加催化剂对反应速率影响的图像是________(填序号,下同),平衡________移动。
(2)升高温度对反应速率影响的图像是________,平衡向________方向移动。
(3)增大反应容器体积对反应速率影响的图像是________,平衡向________方向移动。
(4)增大O2的浓度对反应速率影响的图像是__________,平衡向________方向移动。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的逆反应为________热反应,且m+n______p (填“>”、“=”或“<”) 。
(2)减压时,A的质量分数__________。(填“增大”、“减小”或“不变”,下同)
(3)若容积不变加入B,则A的转化率__________,B的转化率__________。
(4)若升高温度,则平衡时B、C的浓度之比将__________。
(5)若加入催化剂,平衡时气体混合物的总物质的量__________。
(6)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色__________;而维持容器内压强不变,充入氖气时,混合物颜色 。(填“变深”、“变浅”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某学生为了探究锌与盐酸反应过程中速率变化。在100mL稀盐酸中加入足量的锌粉,标准状况下测得数据累计值如下:
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
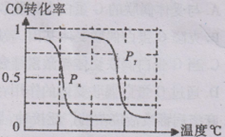
甲醇是一种很好的燃料,工业上用CH4和H2O 为原料,通过反应I和Ⅱ来制备甲醇。
⑴将1.0 mol CH4和2.0 mol H2O(g)通人反应室(容积为100L),在一定条件下发生反应:
CH4(g)+H2O(g) CO(g)+3H2(g)……I。CH4的转化率与温度、压强的关系如右图所示。
CO(g)+3H2(g)……I。CH4的转化率与温度、压强的关系如右图所示。
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为 。
②图中的P1_ P2(填“<”、“>”或“=”),100℃时平衡常数为 。
③该反应的△H 0(填“<”、“>”或“=”)。
(2)在一定条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇: CO(g)+2H2(g) CH3OH(g) △H<0 ……Ⅱ
CH3OH(g) △H<0 ……Ⅱ
④若容器容积不变,下列措施可增加甲醇产率的是
A.升高温度 B.将CH3OH(g)从体系中分离
C.充人He,使体系总压强增大 D.再充人lmol CO和3 mol H2
⑤为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
A.下表中剩余的实验条件数据: a=_ ;b=_ 。
| 实验编号 | T(℃) | n(CO)/n(H2) | P(Mpa) |
| 1 | 150 | 1/3 | 0.1 |
| 2 | a | 1/3 | 5 |
| 3 | 350 | b | 5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com