
�״���һ�ֺܺõ�ȼ�ϣ���ҵ����CH4��H2O Ϊԭ�ϣ�ͨ����ӦI�͢����Ʊ��״���
�Ž�1.0 mol CH4��2.0 mol H2O(g)ͨ�˷�Ӧ��(�ݻ�Ϊ100L)����һ�������·�����Ӧ:
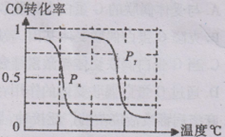
CH4(g)��H2O(g) CO(g)��3H2(g)����I��CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��
CO(g)��3H2(g)����I��CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��
����֪100��ʱ�ﵽƽ�������ʱ��Ϊ5min������H2��ʾ��ƽ����Ӧ����Ϊ ��
��ͼ�е�P1_ P2(�<������>����=��),100��ʱƽ�ⳣ��Ϊ ��
�۸÷�Ӧ�ġ�H 0(�<������>����=��)��
(2)��һ�������£���a mol CO��3a mol H2�Ļ�������ڴ������������Է���Ӧ���ɼ״�: CO(g)+2H2(g) CH3OH(g) ��H<0 ������
CH3OH(g) ��H<0 ������
���������ݻ����䣬���д�ʩ�����Ӽ״����ʵ���
A�������¶� B����CH3OH(g)����ϵ�з���
C������He��ʹ��ϵ��ѹǿ���� D���ٳ���lmol CO��3 mol H2
��Ϊ��Ѱ�Һϳɼ״����¶Ⱥ�ѹǿ������������ijͬѧ���������ʵ�飬����ʵ�������Ѿ���������ʵ����Ʊ��С�
A���±���ʣ���ʵ����������: a=_ ��b=_ ��
| ʵ���� | T���棩 | n(CO)��n(H2) | P(Mpa) |
| 1 | 150 | 1��3 | 0.1 |
| 2 | a | 1��3 | 5 |
| 3 | 350 | b | 5 |
��14�֣���1����0.0030mol/(L��min) ��2�֣� �ڣ� ��2�֣�
2.25��10��4(mol/L)2��2�֣���д��λ���۷֣���λд����1�֣� �ۣ���2�֣�
��2����BD��2�֣� ��A.a��150��b��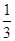 ����1�֣���2�֣� B.0.1��2�֣�
����1�֣���2�֣� B.0.1��2�֣�
���������������1������ͼ���֪��ƽ��ʱ�����ת����Ϊ0.5�����Լ�������ʵ���������1.5mol��0.5��0.5mol�����c(CH4)��0.5mol��100L��0.005mol/L������v(CH4)��0.005mol/L��5min��0.001mol/��L?min��������֮�ȵ��ڻ�ѧ������֮�ȣ�����v(H2)��3v(CH4)��3��0.001mol/��L?min��=0.003mol/��L?min����
���¶���ͬʱ������ֱx��ĸ����ߣ�����ѹǿΪP1��CH4��ת���ʸߣ���ӦΪǰ���������ķ�Ӧ��ѹǿ����ƽ���������С�ķ����ƶ��������淴Ӧ�ƶ���CH4��ת���ʽ��ͣ�����P1��P2����
CH4��g���� H2O��g�� CO��g���� 3H2��g��
CO��g���� 3H2��g��
��ʼŨ�ȣ�mol/L�� 0.010 0.020 0 0
ת��Ũ�ȣ�mol/L�� 0.005 0.005 0.005 0.015
ƽ��Ũ�ȣ�mol/L�� 0.005 0.015 0.005 0.015
����ƽ�ⳣ��K��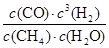 =
=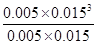 ��2.25��10-4��
��2.25��10-4��
����ͼ��֪���¶�Խ�����ת����Խ�������¶�ƽ��������Ӧ�����ƣ��¶�����ƽ�������ȷ����ƶ�����������ӦΪ���ȷ�Ӧ������H��0��
��2����A���÷�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ȷ����ƶ��������淴Ӧ�����ƶ����״��IJ��ʽ��ͣ���A����B����CH3OH��g������ϵ�з��룬�����Ũ�Ƚ��ͣ�ƽ��������Ӧ�ƶ����״��IJ������ӣ���B����C������He��ʹ��ϵ��ѹǿ���������ݻ����䣬��Ӧ���������Ũ�Ȳ��䣬ƽ�ⲻ�ƶ����״��IJ��ʲ��䣬��C����D���ٳ���1molCO��3molH2���ɵ�ЧΪѹǿ����ƽ���������С�ķ����ƶ�����������Ӧ�����ƶ����״��IJ������ӣ���D��ȷ����ѡBD��
��A����ȡ���Ʊ�������̽���ϳɼ״����¶Ⱥ�ѹǿ�����������������¶ȡ�ѹǿ�DZ仯�ģ�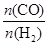 Ӧ���ֲ��䣬����b��
Ӧ���ֲ��䣬����b��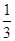 ���Ƚ�ʵ��1��2��֪��ѹǿ��ͬ�������¶�Ӧ��ͬ����a��150��
���Ƚ�ʵ��1��2��֪��ѹǿ��ͬ�������¶�Ӧ��ͬ����a��150��
B���¶���ͬʱ������ֱx��ĸ����ߣ�����ѹǿΪPy��CO��ת���ʸߣ���ӦΪǰ�������С�ķ�Ӧ��ѹǿ����ƽ���������С�ķ����ƶ�����������Ӧ�ƶ�������Px��Py�����ѹǿPx��0.1Mpa��
���㣺���鷴Ӧ���ʡ�ƽ�ⳣ���ļ��㣻���������ƽ��״̬��Ӱ���Լ�ͼ��ʶ���


 ��1����Ԫ�¿�������ĩϵ�д�
��1����Ԫ�¿�������ĩϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�о�NO2����CO�ȴ�����Ⱦ����Ĵ���������Ҫ���塣
���÷�Ӧ6NO2(g)��8NH3(g)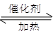 7N2(g)��12 H2O(g)�ɴ���NO2��700��ʱ�����ݻ�Ϊ2L���ܱ������г���һ������NO2��NH3, ��Ӧ�����вⶨ�IJ������ݼ��±�
7N2(g)��12 H2O(g)�ɴ���NO2��700��ʱ�����ݻ�Ϊ2L���ܱ������г���һ������NO2��NH3, ��Ӧ�����вⶨ�IJ������ݼ��±�
| ��Ӧʱ��/min | n(NO2)/mol | n(NH3)/ mol |
| 0 | 1��20 | 1��60 |
| 2 | 0��90 | |
| 4 | | 0��40 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(12��)�����Ϊ2L�Ĺ̶��ܱ�������ͨ��3molX����,��һ���¶��·������·�Ӧ��
2X(g) Y(g)+3Z(g)
Y(g)+3Z(g)
��1����5min��Ӧ�ﵽƽ��,��ʱ��������ڵ�ѹǿΪ��ʼʱ��1.2��,����Y�����ʵ���Ũ�ȱ仯��ʾ������Ϊ ��
��2����������Ӧ�ڼס��ҡ��������ĸ�ͬ�����ܱ������н���,��ͬһ��ʱ���ڲ�������ڵķ�Ӧ���ʷֱ�Ϊ����v(X)��3.5mol/(L?min)����v(Y)��2mol/(L?min)����v(Z)=4.5mol/(L?min)����v(X)��0.075mol/(L?s)��������������ͬ,�¶Ȳ�ͬ�����¶��ɸߵ��͵�˳����(�����) ��
��3������ﵽ(1)��ƽ����ϵ�г������,��ƽ���� (��"��"��"��"��"��")�ƶ�������
�ﵽ(1)��ƽ����ϵ�����߲��ֻ������,��ƽ���� (��" �� " �� " �� " �� " ��")�ƶ���
��4��������ͬ��������ﵽ(1)������ƽ����ϵ���ٳ���0.5molX����,��ƽ���X��ת���ʢ���ŵ�
ƽ���е�X��ת������Ƚ� ��
| A����ȷ�� | B����һ�����ڢ� | C����һ�����ڢ� | D����һ��С�ڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��һ�̶��ݻ�Ϊ2L���ܱ������ڼ���0.2mol��N2��0.6mol��H2����һ�������·������·�Ӧ��N2(g)��3H2(g) 2NH3(g) ��H��0 ����Ӧ��NH3�����ʵ���Ũ�ȵı仯�������ͼ��ʾ����ش��������⣺
2NH3(g) ��H��0 ����Ӧ��NH3�����ʵ���Ũ�ȵı仯�������ͼ��ʾ����ش��������⣺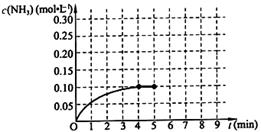
����ͼ������ӷ�Ӧ��ʼ��ƽ��ʱ��ƽ����Ӧ����v(NH3)= ��
��������������˵��������Ӧ�Ѵ�ƽ����� ��
| A��3v����H2����2v����NH3�� |
| B�������������ƽ����Է���������ʱ����仯 |
| C��������������ܶȲ���ʱ����仯 |
| D������������ķ�����������ʱ����仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��1���̶�������CO2����Ч��������Դ�������ٿ����е��������塣��ҵ����һ����CO2�������״�ȼ�ϵķ�����CO2(g)��3H2(g) CH3OH(g)��H2O(g)��H����49��0kJ��mol��1��ij��ѧʵ�齫6molCO2��8molH2����2L�ܱ������У����H2�����ʵ�����ʱ��仯����ͼ��ʾ��ʵ�ߣ���ͼ������a��1��6����������˼�ǣ���l minʱH2�����ʵ�����6mol��
CH3OH(g)��H2O(g)��H����49��0kJ��mol��1��ij��ѧʵ�齫6molCO2��8molH2����2L�ܱ������У����H2�����ʵ�����ʱ��仯����ͼ��ʾ��ʵ�ߣ���ͼ������a��1��6����������˼�ǣ���l minʱH2�����ʵ�����6mol��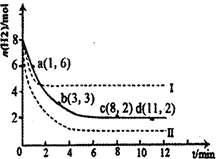
������ʱ���ƽ����Ӧ����������__________����С����______________��
| A��0��1min | B��1��3min | C��3��8min | D��8��11min |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�о�NO2��SO2��CO�ȴ�����Ⱦ��Ĵ���������Ҫ���塣NO2�������з�Ӧ��������
6 NO2(g)+8NH3(g)  7N2(g)+12H2O(g)+Q��Q��0����
7N2(g)+12H2O(g)+Q��Q��0����
���������գ�
��1����Ӧ��ƽ�ⳣ������NO2��Ч�ʸߡ�����÷�Ӧƽ�ⳣ���Ĵ�ʩ�� ��
��2��һ��������������Ӧ��ij����̶����ܱ������н��У���˵���÷�Ӧ�Ѿ��ﵽƽ��״̬���� ��
a��c(NO2)��c(NH3) = 3��4 b��6v(NO2) = 7v(N2)
c��������������ѹǿ���ٱ仯 d�������������ܶȲ��ٱ仯
��3����ƽ��ʱNO2��N2��Ũ��֮��Ϊm/n�����������������䣬��С��Ӧ�����������ﵽ�µ�ƽ�⣬��ʱNO2��N2��Ũ��֮�� m/n���>������=����<������
��4��ij�¶��£���һ���ݻ�Ϊ2���ķ�Ӧ�����ڣ�������Ӧ2���Ӻ�ﵽƽ�⣬��øպ���3mol���ӷ���ת�ƣ�����2������NH3��ƽ����Ӧ����Ϊ��
v(NH3) = ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��������;�㷺����Ҫ��������Ӳ�ʻ����µĺϽ��Լ����ݵĵ�˿�������£����ܱ���������H2��ԭWO3�ɵõ������٣����ܷ�ӦΪ��
WO3 (s) + 3H2 (g)  W (s) + 3H2O (g) ��ش��������⣺
W (s) + 3H2O (g) ��ش��������⣺
��1����һ���¶��½���������Ӧ������Ӧ�������ݻ�Ϊ0��5 L��2min��ﵽƽ�⣬��ù��������������4��80 g����H2��ƽ����Ӧ����_________���÷�Ӧ��ƽ�ⳣ������ʽK=___________
��2��ij�¶��·�Ӧ��ƽ��ʱ��H2��ˮ�����������Ϊ2:3����H2��ƽ��ת����Ϊ__________�����¶ȵ����ߣ�H2��ˮ����������ȼ�С����÷�ӦΪ ____������ȡ����ȡ��� ��Ӧ��
��3��һ���¶��£����ܱպ��ݵ������У��ܱ�ʾ������Ӧ�ﵽ��ѧƽ��״̬����________��
A������������ѹǿ���ֲ��� B��v��(H20)= v��(H2)
C�����������ܶȱ��ֲ��� D����������ƽ��ʽ�����ֲ���
��4����˿�ƹ��е�W��ʹ�ù����л����ӷ���ʹ��˿��ϸ������I2���ӳ��ƹܵ�ʹ���������乤��ԭ��Ϊ��W (s) +2I2 (g)  WI4 (g)������˵����ȷ����__________��
WI4 (g)������˵����ȷ����__________��
A���¶�����ʱ��WI4�ķֽ����ʼӿ죬W��I2�Ļ������ʼ���
B��WI4�ڵ�˿�Ϸֽ⣬������W�ֳ����ڵ�˿��
C��WI4�ڵƹܱ��Ϸֽ⣬ʹ�ƹܵ������ӳ�
D���ƹ��ڵ�I2��ѭ��ʹ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�û�ѧ��Ӧԭ�����֪ʶͬ��
I�������±���ʾ��ѧ��Ӧ�����ݹ�ϵ�ش��������⣺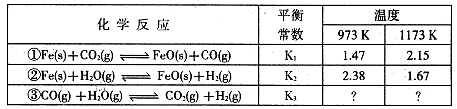
��1����Ӧ���� �������"���ȡ�����Ӧ��
��2�����ݷ�Ӧ����ڿ��Ƶ���ͬ����K1��K2��K3֮��Ĺ�ϵ����K3= ����K1��K2��ʾ����
��3������Ӧ�۵��淴Ӧ������ʱ��Ĺ�ϵ��ͼ��ʾ��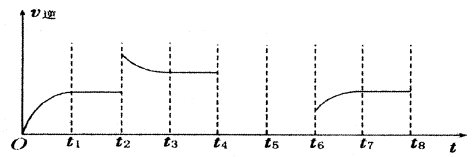
�ٷ�Ӧ��t1��t3��t7ʱ���ﵽ��ƽ�⣬��t2ʱֻ�ı���һ���������j���жϣ��ı������������ ��
����t4ʱ��ѹ��t6ʱ����Ӧ���Ũ�ȣ�����ͼ�л���t4��t6ʱ�淴Ӧ������ʱ��Ĺ�ϵ���ߡ�
II������ݴ���ĵ���ƽ��ش��������⣺
��1�������£�0.1mol��L ��CH3COOH��Һ����l����CH3COOH���ӷ������룬����Һ��pH= ��
��2����������Һ������ˮϡ�ͣ���ϡ�����У����и������������ ������ĸ��ţ���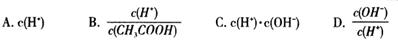
��3��25��ʱ��CH3COOH�ĵ���ƽ�ⳣ��Ϊ1��75��10-5���ֽ�һ������CH3COOH��NaOH��Һ��ϣ�����û��ҺpH=5��6������Һ�и�����Ũ���ɴ�С��˳���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
�ں��¡���ѹ��ʹ�ô����������£���֪�����ݻ��ɱ���ܱ������У�����1 L��3 mol H2��1 mol N2�Ļ�����壬��Ӧ��ƽ��ʱ��a mol NH3���ɣ�N2��ת����Ϊb%��
��1�����ں��¡���ѹ��ʹ�ô����������£�������ɱ���ܱ������г���x mol H2��y mol N2����Ӧ��ƽ��ʱ��3a mol NH3���ɣ�N2��ת������Ϊb%����x= ;
y= ��
��2���ں��¡���ѹ��ʹ�ô����������£���������ɱ���ܱ������г���x mol H2��y mol N2��z mol NH3������ƽ��ʱN2ת������Ϊb%����x��y�Ĺ�ϵΪ ��z��ȡֵ��ΧΪ ��
��3���ں��£��루1���¶���ͬ�ݺ�ʹ�ô����������£����ݻ����ɱ���ܱ������У�����1 L��3 mol H2��1 mol N2�Ļ�����壬��Ӧ��ƽ��ʱN2��ת����Ϊc%����b��c�Ĺ�ϵΪ ���á�<������=����>����ʾ���������� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com