
【题目】有机物X是一种重要的有机化工原料,下图是以它为初始原料设计出的转化关系图(部分产物、合成路线、反应条件略去),Y是一种功能高分子材料。

已知:
(1)X为芳香烃,其相对分子质量为92;
(2)烷基苯在高锰酸钾的作用下,侧链被氧化成羧基:![]() ;
;
(3)![]() (苯胺,易被氧化);
(苯胺,易被氧化);
回答下列问题:
(1)X的名称为________________,G的分子式为____________________。
(2)F的结构简式为___________________,B中官能团的名称为____________。
(3)F→G的反应类型为__________________________。
(4)G→Y的化学方程式为__________________________。
(5)满足下列条件的B的同分异构体有________种。
①含有苯环;②只含一种官能团;③1 mol该有机物能与2 mol NaHCO3完全反应。
(6)请写出以C为原料制备![]() 的合成路线流程图(无机试剂任用)。_______________。
的合成路线流程图(无机试剂任用)。_______________。
【答案】甲苯 C7H7NO2 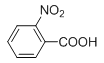 羧基 酯基 还原反应
羧基 酯基 还原反应 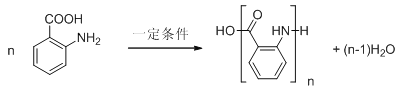 10
10 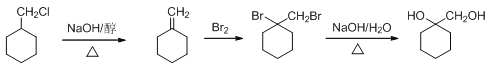
【解析】
相对分子质量为92的某芳香烃X是一种重要的有机化工原料,令分子组成为CxHy,则![]() =7…8,由烷烃中C原子与H原子关系可知,该烃中C原子数目不能小于7,故该芳香烃X的分子式为C7H8,结构简式为
=7…8,由烷烃中C原子与H原子关系可知,该烃中C原子数目不能小于7,故该芳香烃X的分子式为C7H8,结构简式为![]() 。
。 ![]() 在浓硫酸、加热条件下与浓硝酸发生取代反应生成E,结合G的结构可知E为
在浓硫酸、加热条件下与浓硝酸发生取代反应生成E,结合G的结构可知E为![]() ,E转化生成F,由于苯胺容易被氧化,由反应信息Ⅰ、反应信息Ⅱ可知,F为
,E转化生成F,由于苯胺容易被氧化,由反应信息Ⅰ、反应信息Ⅱ可知,F为![]() ,
,![]() 发生反应生成Y,Y为功能高分子化合物,故Y的结构简式为
发生反应生成Y,Y为功能高分子化合物,故Y的结构简式为![]() 。
。
(1)通过以上分析知,X为![]() ,为甲苯;G(
,为甲苯;G(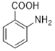 )的分子式为C7H7NO2,故答案为:甲苯;C7H7NO2;
)的分子式为C7H7NO2,故答案为:甲苯;C7H7NO2;
(2)F为![]() ,B(
,B(![]() )中官能团的名称为酯基和羧基,故答案为:
)中官能团的名称为酯基和羧基,故答案为:![]() ;酯基、羧基;
;酯基、羧基;
(3)F(![]() )→G(
)→G( )反应中硝基被还原为氨基,故答案为:还原反应;
)反应中硝基被还原为氨基,故答案为:还原反应;
(4)邻氨基苯甲酸在一定条件下反应生成Y,反应④的化学方程式为n![]()
![]()
![]() +(n-1)H2O,故答案为:n
+(n-1)H2O,故答案为:n![]()
![]()
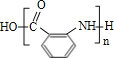 +(n-1)H2O;
+(n-1)H2O;
(5)B为(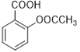 ),其同分异构体满足下列条件:①含有苯环;②只含一种官能团;③1mol该有机物能与2molNaHCO3完全反应,说明含有两个羧基。如果取代基为-COOH、-CH2COOH,有邻间对3种结构;如果取代基为-CH(COOH)2,有1种结构;如果取代基为两个-COOH、一个-CH3,两个-COOH为相邻位置,有2种同分异构体;如果两个-COOH为相间位置,有3种同分异构体;如果两个-COOH为相对位置,有1种同分异构体;所以符合条件的有10种,故答案为:10;
),其同分异构体满足下列条件:①含有苯环;②只含一种官能团;③1mol该有机物能与2molNaHCO3完全反应,说明含有两个羧基。如果取代基为-COOH、-CH2COOH,有邻间对3种结构;如果取代基为-CH(COOH)2,有1种结构;如果取代基为两个-COOH、一个-CH3,两个-COOH为相邻位置,有2种同分异构体;如果两个-COOH为相间位置,有3种同分异构体;如果两个-COOH为相对位置,有1种同分异构体;所以符合条件的有10种,故答案为:10;
(6)以C(![]() )为原料制备
)为原料制备![]() ,
, ![]() 在氢氧化钠醇溶液、加热条件下发生消去反应生成
在氢氧化钠醇溶液、加热条件下发生消去反应生成![]() ,与溴发生加成反应,所得产物在氢氧化钠水溶液中发生水解反应生成
,与溴发生加成反应,所得产物在氢氧化钠水溶液中发生水解反应生成![]() ,合成反应流程图为:
,合成反应流程图为: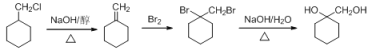 ,故答案为:
,故答案为: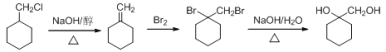 。
。


科目:高中化学 来源: 题型:
【题目】用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定)。Q点时欲使溶液恢复到起始状态,可向溶液中加入
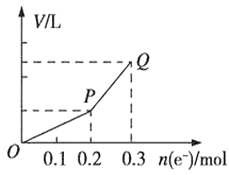
A. 0.1 mol CuO
B. 0.1 mol CuCO3
C. 0.1 mol Cu(OH)2
D. 0.05 mol Cu2(OH)2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g),是工业制硫酸的主要反应之一。
2SO3(g),是工业制硫酸的主要反应之一。
(1)该反应过程的能量变化如图所示:

由图中曲线变化可知,该反应为______(填“放热”或“吸热”)反应。该反应通常用V2O5作催化剂,加入V2O5后,改变的是图中的_____。
A.△H B.E C.△H-E D.△H+E
(2)在2L绝热密闭容器中投入2molSO2和bmolO2,下图是部分反应物随时间的变化曲线。

①10min时,v(SO3)=_____。
②反应达到平衡时,SO2的转化率为______。
③下列情况能说明该反应达到化学平衡的是_____
A. v(SO3)=v(SO2) B.混合气体的密度保持不变
C.t时刻,体系的温度不再发生改变 D.混合气体的总物质的量不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:
CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.1
COS(g)+H2(g) K=0.1
反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是
A. 升高温度,H2S浓度增加,表明该反应是吸热反应
B. 通入CO后,正反应速率逐渐增大
C. 反应前H2S物质的量为7mol
D. CO的平衡转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于石油、天然气等资源的说法不正确的是( )
A.石油裂化得到的汽油是纯净物
B.石油裂化的主要目的是为了提高轻质液体燃料的产量
C.天然气是一种清洁的化石燃料
D.通过煤焦油的分馏可以获得各种芳香烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是

A. 正极反应为AgCl +e-=Ag +Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(8分)高炉炼铁过程中发生的主要反应为
![]()
已知该反应在不同温度下的平衡常数如下:

请回答下列问题:
(1)该反应的平衡常数表达式K=_____________,△H________0(填“>”、“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过l0 min后达到平衡。求该时间范围内反应的平均反应速率υ(C02)= _____________、CO的平衡转化率= _____________:
(3)欲提高(2)中CO的平衡转化率,可采取的措施是_____________。
A.减少Fe的量 | B.增加Fe203的量 | C.移出部分C02 |
D.提高反应温度 E.减小容器的容积 F.加入合适的催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果酸分子的结构简式为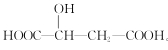 。下列说法正确的是
。下列说法正确的是
A. 1mol苹果酸与足量金属Na反应生成1mol H2
B. 1mol苹果酸可与3mol NaOH发生反应
C. 苹果酸分子中的官能团有羟基和羧基
D. ![]() 与苹果酸互为同分异构体
与苹果酸互为同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com