
【题目】(8分)高炉炼铁过程中发生的主要反应为
![]()
已知该反应在不同温度下的平衡常数如下:

请回答下列问题:
(1)该反应的平衡常数表达式K=_____________,△H________0(填“>”、“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过l0 min后达到平衡。求该时间范围内反应的平均反应速率υ(C02)= _____________、CO的平衡转化率= _____________:
(3)欲提高(2)中CO的平衡转化率,可采取的措施是_____________。
A.减少Fe的量 | B.增加Fe203的量 | C.移出部分C02 |
D.提高反应温度 E.减小容器的容积 F.加入合适的催化剂 |
【答案】![]()
【解析】
试题(1)根据化学平衡常数的定义可知:K=c(CO2)/c(CO)。由于温度升高化学平衡常数。说明升高温度,平衡向逆反应方向移动。逆反应是吸热反应,该反应的正反应为放热反应 △H<0;
(2) 1/3Fe2O3(s)+ CO(g) ![]() 2/3Fe(s) + CO2(g)
2/3Fe(s) + CO2(g)
起: 1 mol 1 mol 1 mol 1 mol
变: 1/3x x 2/3x x
终: 1 mol- 1/3x 1 mol- x 1 mol+ 2/3x 1 mol+ x
平衡常数只与温度有关,且已知1000℃时 K=4.0
即:K=c(CO2)/c(CO)=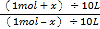 解得:x = 0.6 mol 则υ(CO2)= 0.6 mol/ (10L·l0 min) = 0.006 mol/ (L·min)
解得:x = 0.6 mol 则υ(CO2)= 0.6 mol/ (10L·l0 min) = 0.006 mol/ (L·min)
CO的平衡转化率=![]() ℅ = 60℅
℅ = 60℅
(3)因Fe和Fe2O3为固体,对平衡没有影响所以A、B错误;C中CO2为气体生成物,减少生成物浓度平衡向正反应方向移动,故C正确;升高温度平衡向吸热反应方向移动。对于该反应来说是向逆反应方向移动,CO的平衡转化率降低。D错误;因为该反应是前后气体相等的可逆反应。所以减小容器的容积也就是增大压强。化学平衡不发生移动。CO的平衡转化率不变。E错误;催化剂只改变化学反应速率而不影响平衡的移动,故F错误。


科目:高中化学 来源: 题型:
【题目】磷化铝(AlP)是一种常用于粮食仓储的广谱性熏蒸杀虫剂,遇水立即产生高毒性气体PH3(沸点-89.7℃,还原性强)。国家卫计委规定粮食中磷化物(以PH3计)的残留量不超过0.05mg/kg时为质量合格,反之不合格。某化学兴趣小组的同学用下述方法测定某粮食样品中残留磷化物的质量以判断是否合格。
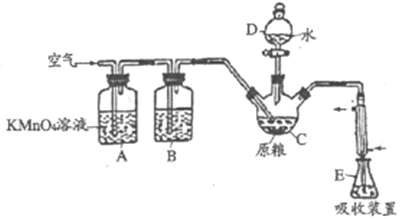
在C中加入100g原粮,E中加入20.00mL2.50×10-4mol/ L KMnO4溶液(H2SO4酸化),往C中加入足量水,充分反应后,用亚硫酸钠标准溶液滴定E中过量的KMnO4溶液。回答下列问题:
(1)PH3的电子式为___________。仪器D的名称是___________。
(2)通入空气的作用是___________。
(3)装置B中盛装焦性没食子酸的碱性溶液,其作用是吸收空气中的O2。若去掉该装置,对实验的影响为___________。
(4)装置E中PH3被氧化成磷酸,则装置E中发生反应的离子方程式为__________。收集装置E中的吸收液,加水稀释至250mL,取25.00mL于锥形瓶中,用4.0×10-5mol/L的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液20.00mL,Na2SO3与KMnO4溶液反应的离子方程式为:SO32-+MnO4-+H+→SO42-+Mn2++H2O(未配平),则该原粮样品中磷化物(以PH3计)的质量为__________mg。该原粮样品__________(填“合格”或“不合格”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X是一种重要的有机化工原料,下图是以它为初始原料设计出的转化关系图(部分产物、合成路线、反应条件略去),Y是一种功能高分子材料。

已知:
(1)X为芳香烃,其相对分子质量为92;
(2)烷基苯在高锰酸钾的作用下,侧链被氧化成羧基:![]() ;
;
(3)![]() (苯胺,易被氧化);
(苯胺,易被氧化);
回答下列问题:
(1)X的名称为________________,G的分子式为____________________。
(2)F的结构简式为___________________,B中官能团的名称为____________。
(3)F→G的反应类型为__________________________。
(4)G→Y的化学方程式为__________________________。
(5)满足下列条件的B的同分异构体有________种。
①含有苯环;②只含一种官能团;③1 mol该有机物能与2 mol NaHCO3完全反应。
(6)请写出以C为原料制备![]() 的合成路线流程图(无机试剂任用)。_______________。
的合成路线流程图(无机试剂任用)。_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,向密闭容器中充入30 mL CO和20 mL水蒸气,使其反应;当反应CO(g)+H2O(g) ![]() CO2(g)+H2(g)达到平衡时,水蒸气的体积分数与H2的体积分数相等,则下列叙述错误的是
CO2(g)+H2(g)达到平衡时,水蒸气的体积分数与H2的体积分数相等,则下列叙述错误的是
A. 平衡后CO的体积分数为40%
B. 平衡后CO的转化率为25%
C. 平衡后水的转化率为50%
D. 平衡后混合气体的平均相对分子质量为24
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2和H2合成NH3的能量变化如图所示,该反应的热化学方程式是

A. N2(g)+3H2(g)![]() 2NH3(l) ΔH=2(a-b-c) kJ·mol-1
2NH3(l) ΔH=2(a-b-c) kJ·mol-1
B. N2(g)+3H2(g)![]() 2NH3(g) ΔH=2(b-a) kJ·mol-1
2NH3(g) ΔH=2(b-a) kJ·mol-1
C. 1/2N2(g)+3/2H2(g)![]() NH3(l) ΔH=(b+c-a) kJ·mol-1
NH3(l) ΔH=(b+c-a) kJ·mol-1
D. 1/2N2(g)+3/2H2(g)![]() NH3(g) ΔH=(a+b) kJ·mol-1
NH3(g) ΔH=(a+b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.热化学方程式中,若没有注明温度和压强,则表示反应热是在标准状况下测得的数据
B.升高温度或加入催化剂,可以改变化学反应的反应热
C.据能量守恒定律,反应物的总能量一定等于生成物的总能量
D.反应产物的总焓大于反应物的总焓时,反应吸热,ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明:多种海产品如虾、蟹、牡蛎等,体内含有+5价的砷(As)元素,但它对人体是无毒的,砒霜的成分是As2O3,属剧毒物质,专家忠告:吃饭时不要同时大量食用海鲜和青菜,否则容易中毒,并给出了一个公式:大量海鲜+大量维生素C=砒霜。下面有关解释不正确的是
A.维生素C能将+5价砷氧化成As2O3
B.维生素C具有还原性
C.青菜中含有维生素C
D.使人中毒的过程中砷元素发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如下图所示。

(1)富集溴一般先用热空气或水蒸气吹出单质溴,再用SO2的水溶液将其还原吸收,发生反应的化学方程式为_____________________。
(2)为了使Mg2+转化为Mg(OH)2,试剂①可以用_________________(填化学式)
(3)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为_______。
(4)下列有关海水综合利用的说法错误的是_____(填字母代号)。
A.粗盐可采用除杂和结晶等过程提纯 B.电解饱和食盐水可制得金属钠
C.向滤液中通入C12是为了氧化Br- D.海水提镁过程中涉及复分解反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com