
【题目】在给定的条件下,下列选项所示的物质间转化均能实现的是( )
A.MnO2![]() Cl2
Cl2![]() 漂白粉
漂白粉
B.Fe3O4![]() Fe
Fe![]() FeCl3溶液
FeCl3溶液
C.Al![]() NaAlO2
NaAlO2![]() Al(OH)3
Al(OH)3
D.饱和NaCl溶液![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
【答案】D
【解析】
A. MnO2与稀盐酸在加热条件下不能反应,不能实现物质间转化,A不符合题意;
B. Al与Fe3O4在高温下发生铝热反应产生Fe单质,Fe与稀盐酸反应产生FeCl2,不能产生FeCl3,故不能实现上述物质间转化,B不符合题意;
C. Al与NaOH溶液反应产生NaAlO2,向NaAlO2溶液中加入过量盐酸,反应产生AlCl3,因此不能实现上述物质间转化,C不符合题意;
D. 向饱和NaCl溶液中通入NH3,然后再通入CO2气体,发生反应:NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl,然后将NaHCO3固体过滤,加热,发生分解反应:2NaHCO3![]() Na2CO3+CO2↑+H2O,得到Na2CO3,能实现上述物质间转化,D符合题意;
Na2CO3+CO2↑+H2O,得到Na2CO3,能实现上述物质间转化,D符合题意;
故合理选项是D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在![]() 下,将m
下,将m![]() 的醋酸溶液与n
的醋酸溶液与n![]() 的氢氧化钠溶液等体积混合,恰好使反应后的溶液呈中性,则下列观点正确的是
的氢氧化钠溶液等体积混合,恰好使反应后的溶液呈中性,则下列观点正确的是
A.反应后的溶液中:![]()
B.反应前溶液的物质的量浓度:![]()
C.反应后的溶液中:![]()
![]()
D.该温度下,醋酸的电离平衡常数的表达式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2 )在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH 3OH(g)+H2O(g) △H2
CH 3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
已知反应①中相关的化学键键能数据如下:
化学键 | H—H | C—O |
| H—O | C—H |
E/(kJ mol-1) | 436 | 343 | 1076 | 465 | 413 |
回答下列问题:
(1)CH3OH中氧在周期表中位于___,属于___区元素,与其同周期相邻两种元素原子的第一电离能由大到小的顺序为___(用元素符号表示),其原因是___。
(2)写出CH3OH的结构式___;反应①的热化学方程式(热量用具体数值表示)___。
(3)当△H2=-58kJ mol-1,则△H3=__kJ mol-1。
(4)CO和H2的混合气体又称水煤气,可由水和煤在一定条件下产生,写出该反应的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2 L容器中三种物质的物质的量随时间的变化曲线如图所示。由图中数据分析,该反应的化学方程式和反应开始至2 min末Z的平均反应速率分别为( )
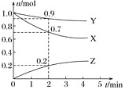
A.X+3Y![]() 2Z 0.1 mol L-1min-1B.2X+Y
2Z 0.1 mol L-1min-1B.2X+Y![]() 2Z 0.1 mol L-1min-1
2Z 0.1 mol L-1min-1
C.X+2Y![]() Z 0.05 mol L-1min-1D.3X+Y
Z 0.05 mol L-1min-1D.3X+Y![]() 2Z 0.05 mol L-1min-1
2Z 0.05 mol L-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含n mol AlCl3的溶液中加入m mol NaOH溶液,观察到的现象是先有白色沉淀生成,后部分溶解,则生成Al(OH)3沉淀的物质的量是( )
A.(4n-m)molB.(4m-n)molC.(n-3m)molD.(3m-n)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫—空气质子交换膜燃料电池将化学能转变成电能的同时,实现了制硫酸、发电、环保三位一体的结合,降低了成本提高了效益,其原理如图所示。下列说法错误的是( )

A. Pt1电极附近发生的反应为:SO2+2H2O-2e-===SO![]() +4H+
+4H+
B. Pt2电极附近发生的反应为O2+4e-===2O2-
C. 该电池放电时电子从Pt1电极经过外电路流到Pt2电极
D. 相同条件下,放电过程中消耗的SO2和O2的体积比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图所示,U形管内盛有100mL的溶液,按要求回答下列问题:

(1)打开K2 ,合并K1 ,若所盛溶液为CuSO4溶液: B极的电极反应式为 ______
(2)打开K1,合并K2,若所盛溶液为滴有酚酞的KCl溶液,则:总反应化学方程式是 __________________。
(3)反应一段时间后打开K2,若忽略溶液的体积变化和气体的溶解,B极产生气体的体积(标准状况)为11.2mL,将溶液充分混合,常温下溶液的pH约为 ________。若要使电解质溶液恢复到原状态,需向U形管内加入或通入一定量的 __________。
Ⅱ.CO用途广泛,工业应用时离不开平衡思想的指导:在某一容积为5L的体积不变的密闭容器内,加入0.3 mol 的CO和0.3mol的H 2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H20(g)![]() CO2(g)+H2(g) △H>0,反应中CO2的浓度随时间变化情况如下图:
CO2(g)+H2(g) △H>0,反应中CO2的浓度随时间变化情况如下图:

(1)根据图上数据,该温度(800℃)下的平衡常数K=____________________________。
(2)在体积不变的条件下,改变下列条件能使平衡常数K增大的有______________(填字母)
A.升高温度 B.降低温度 C.增大压强 D.减小压强 E.加入催化剂 G.移出一氧化碳气体
(3)若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.3mol的水蒸气,重新达到平衡后,H2O的转化率______________(填“升高”、“降低”、“不变”)。
(4)在催化剂和800℃的条件下,在某一时刻测得c(CO)=c(H2O)= 0.09mol·L-1;c(CO2)=c(H2)= 0.13 mol·L-1,则此时正、逆反应速率的大小:υ正_________υ逆(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨炔是由1,3-二炔键与苯环形成的平面网状结构的全碳分子,具有优良的化学稳定性和半导体性能。下列关于石墨炔的说法不正确的是
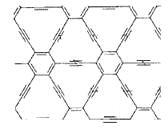
A.石墨炔属于芳香烃
B.石墨炔与金刚石互为同素异形体
C.石墨炔有望代替半导体材料硅在电子产品中得到广泛应用
D.石墨炔孔径略大于H2分子的直径,因此它是理想的H2提纯薄膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。下图为少量HCl气体分子在253 K冰表面吸附和溶解过程的示意图。下列叙述错误的是

A. 冰表面第一层中,HCl以分子形式存在
B. 冰表面第二层中,H+浓度为5×103 mol·L1(设冰的密度为0.9 g·cm3)
C. 冰表面第三层中,冰的氢键网格结构保持不变
D. 冰表面各层之间,均存在可逆反应HCl![]() H++Cl
H++Cl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com