
【题目】二氧化硫—空气质子交换膜燃料电池将化学能转变成电能的同时,实现了制硫酸、发电、环保三位一体的结合,降低了成本提高了效益,其原理如图所示。下列说法错误的是( )

A. Pt1电极附近发生的反应为:SO2+2H2O-2e-===SO![]() +4H+
+4H+
B. Pt2电极附近发生的反应为O2+4e-===2O2-
C. 该电池放电时电子从Pt1电极经过外电路流到Pt2电极
D. 相同条件下,放电过程中消耗的SO2和O2的体积比为2∶1
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】丹参醇是存在于中药丹参中的一种天然产物。合成丹参醇的部分路线如下:
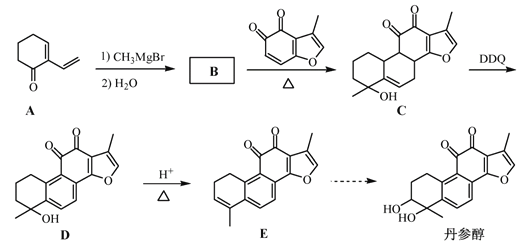
已知: 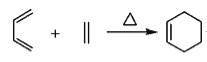
(1)C中的含氧官能团名称为羟基、_____和______。
(2)D![]() E的反应类型为__________________。
E的反应类型为__________________。
(3)B的分子式为C9H14O,写出B的结构简式:__________________。
(4)写出以![]() 和
和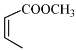 为原料制备
为原料制备![]() 的合成路线流程图(无机试剂和乙醇任用,合成路线流程图示例见本题题干)________________。
的合成路线流程图(无机试剂和乙醇任用,合成路线流程图示例见本题题干)________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气中氮氧化物和碳氢化合物受紫外线作用可产生二次污染物光化学烟雾,其中某些反应过程如图所示。下列说法不正确的是( )

A. NO2不是酸性氧化物B. O2和O3是氧的两种同素异形体
C. 反应I属于氧化还原反应D. 烟雾是一种固溶胶,其分散剂是空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d是淡黄色粉末,m为元素Y的单质,通常为无色无味的气味。上述物质的转化关系如图所示。下列说法错误的是
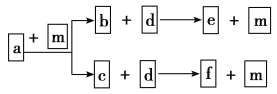
A.简单离子半径:Z<YB.阴离子的还原性:Y>W
C.简单气态氢化物的热稳定性:Y>XD.W、Y、Z形成的化合物含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国是最早发现并使用青铜器的国家。司母戊鼎是迄今为止出土的世界上最大、最重的青铜礼器,享有“镇国之宝”的美誉(如图1)。
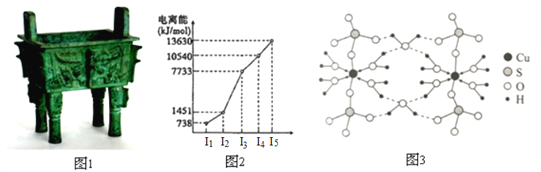
(1)Cu原子的外围电子排布式为_______。
(2)图2所示为第四周期某主族元素的第一至五电离能数据,该元素是_______,I3远大于I2的原因是_______。
(3)图3是某含铜配合物的晶体结构示意图。
①晶体中H2O和SO42-的中心原子的杂化类型为_______,试判断H2O和SO42-的键角大小关系并说明原因_______。
②图3中的氢键有(H2O)O—H···O(H2O)和_______。
③写出该配合物的化学式_______。
(4)一种铜的氯化物晶胞结构如下图所示。
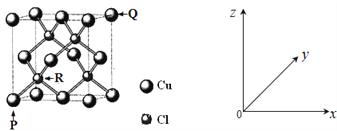
该化合物的化学式为_______,已知P、Q、R的原子坐标分别(0,0,0)、(1,1,1)、 (![]() ,
,![]() ,
,![]() ),若Cu原子与最近的Cl原子的核间距为a pm,则该晶体的密度计算表达式为_______。
),若Cu原子与最近的Cl原子的核间距为a pm,则该晶体的密度计算表达式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由含碘废水制取碘酸钾的一种工艺如下:
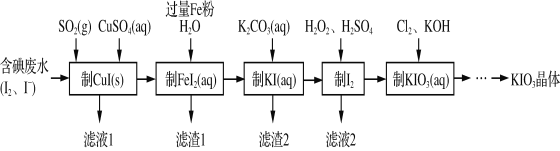
⑴ 写出KIO3在日常生活中的一个重要应用________________________。
⑵ 检验“含碘废水”中是否含有单质I2的常用试剂是________(写试剂名称)。
⑶ 通入SO2的目的是将I2还原为I-,该反应的离子方程式为______________________。
⑷ 工艺中五种物质的制备反应中,不涉及氧化还原反应的步骤是“制________”。
⑸ “制KI(aq)”时,该温度下水的离子积为Kw=1.0×10-13,Ksp[Fe(OH)2]=9.0×10-15。
为避免0.9 mol·L-1 FeI2溶液中Fe2+水解生成胶状物吸附I-,起始加入K2CO3必须保持溶液的pH不大于______。
⑹ “制KIO3溶液”反应的离子方程式为__________________。
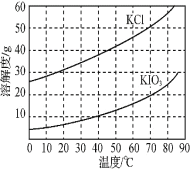
⑺ KCl、KIO3的溶解度曲线如图所示。流程中由“KIO3(aq)”得到KIO3晶体的操作步骤为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)微型纽扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应为Zn+2OH--2e-===ZnO+H2O,Ag2O+H2O+2e-===2Ag+2OH-。根据上述反应式,完成下列题目。

(a)下列叙述正确的是________。
A.在使用过程中,电解质溶液的pH增大
B.使用过程中,电子由Ag2O极经外电路流向Zn极
C.Zn是负极,Ag2O是正极
D.Zn电极发生还原反应,Ag2O电极发生氧化反应
(b)写出电池的总反应式:___________________。
(2)某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
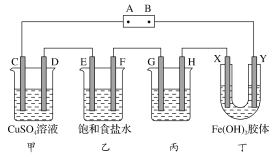
(a)电源A极的名称是________。
(b)甲装置中电解反应的总化学方程式:___________
(c)如果收集乙装置中产生的气体,两种气体的体积比是________。
(d)欲用丙装置给铜镀银,G应该是________(填“铜”或“银”)。
(e)装置丁中的现象是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或实验方案设计正确的是( )
A. 用裂化汽油萃取碘酒中的碘
B. 重结晶法提纯苯甲酸时,为了析出更多晶体,热滤液用冰盐水充分冷却
C. 实验室制乙炔时用饱和食盐水与电石反应,并用硫酸铜溶液除杂质
D. 向乙醇和苯酚混合物加入NaOH溶液,混合后振荡,然后静置分液从而分离它们
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧乙酸(CH3COOOH)不仅在卫生医疗、食品消毒及漂白剂领域有广泛应用,也应用于环境工程、精细化工等领域。实验室利用醋酸(CH3COOH)与双氧水(H2O2)共热, 在固体酸的催化下制备过氧乙酸(CH3COOOH),其装置如下图所示。请回答下列问题:
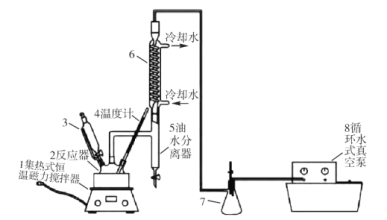
实验步骤:
I.先在反应瓶中加入冰醋酸、乙酸丁酯和固体酸催化剂,开通仪器1和8,温度维持为55℃;
II.待真空度达到反应要求时,打开仪器3的活塞,逐滴滴入浓度为35%的双氧水,再通入冷却水;
Ⅲ.从仪器 5定期放出乙酸丁酯和水的混合物,待反应结束后分离反应器2中的混合物,得到粗产品。
(1)仪器 6的名称是______,反应器 2中制备过氧乙酸(CH3COOOH)的化学反应方程式为_____。
(2)反应中维持冰醋酸过量,目的是提高_____;分离反应器 2中的混合物得到粗产品,分离的方法是_________。
(3)实验中加入乙酸丁酯的主要作用是_________(选填字母序号)。
A 作为反应溶剂,提高反应速率
B 与固体酸一同作为催化剂使用,提高反应速率
C 与水形成沸点更低的混合物,利于水的蒸发,提高产率
D 增大油水分离器 5的液体量,便于实验观察
(4)从仪器 5定期放出乙酸丁酯和水的混合物,待观察到___________(填现象)时,反应结束。
(5)粗产品中过氧乙酸(CH3COOOH)含量的测定:取一定体积的样品 VmL,分成 6等份,用过量 KI溶液与过氧化物作用,以 0.1mol L-1的硫代硫酸钠溶液滴定碘(I2+2S2O32-=2I-+S4O62-);重复 3次,平均消耗量为 V1mL。再以 0.02mol L-1的酸 性高锰酸钾溶液滴定样品,重复 3次,平均消耗量为 V2mL。则样品中的过氧乙酸的浓度为 ______mol L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com