
【题目】某化学兴趣小组利用如图装置进行“铁与水反应”的实验,并检验产物的性质,请回答下列问题:

(1)A装置的作用是__________________,B中反应的化学方程式为____________________________。
(2)D的作用是_______________________________________________。
(3)E中的现象是____________________________________________________________。
(4)A、B两个装置中应先点燃______处的酒精(喷)灯,点燃E处酒精灯之前应进行的操作是_________。
【答案】 产生水蒸气 3Fe+4H2O(g)![]() Fe3O4+4H2 吸收未反应的水蒸气 黑色固体变为红色,右端管壁有水珠生成 A 收集H2,并检验其纯度
Fe3O4+4H2 吸收未反应的水蒸气 黑色固体变为红色,右端管壁有水珠生成 A 收集H2,并检验其纯度
【解析】
(1)铁与水蒸气反应的条件是高温,水的状态是气体,所以A装置的作用是造水蒸气,B中是铁与水蒸气反应生成氢气和四氧化三铁,方程式为: 3Fe+4H2O(g)![]() Fe3O4+4H2;
Fe3O4+4H2;
(2)E是氢气还原氧化铜的实验,气体进入E装置前要干燥,否则会有危险,硬质玻璃管可能炸裂,因此,D的作用是干燥氢气(或除掉氢气中的水蒸气);
(3)氢气还原氧化铜得到铜和水,所以硬质玻璃管中黑色固体变为红色,硬质玻璃管右端管壁有液滴生成;
(4)若先点燃B处,铁会与氧气先发生反应,所以须先点燃A处;氢气是可燃性气体混有空气会发生爆炸,所以点燃E处酒精灯之前应进行的操作是验证氢气的纯度,方法是:收集一试管气体,将试管口靠近酒精灯火焰,弱发出噗的声音,说明气体纯净;若发生尖锐爆鸣声,说明气体不纯。


科目:高中化学 来源: 题型:
【题目】甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)===2H2O(l) △H2=-571.8 kJ/mol;
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g) △H2=-192.9 kJ/mol。
(1)甲醇蒸气完全燃烧的热化学反应方程式为__________________________。
(2)反应②中的能量变化如图所示,则△H2=_______kJ/mol(用E1、E2表示)。

(3)H2(g)的燃烧热为_______。
(4)请你分析H2(g)作为能源比甲醇蒸气作为能源的优点:______(写出两点即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10mL0.1mol/LCaCl2溶液中滴加0.1mol/L的Na2CO3溶液(此时不考虑CO32-的水解),滴加过程中溶液中-lgc(Ca2+)与Na2CO3 溶液体积(V)的关系如图所示,下列有关说法正确的是

A. z 点对应的分散系很稳定
B. w、x、y三点中,水的电离程度最大的为w点
C. 若用等浓度的Na2SO4溶液代替Na2CO3溶液,则图像在x点后的变化如虚线部分所示
D. 此温度下,Ksp(CaCO3)=1x10-8.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生铁在pH=2和pH=4的盐酸中发生腐蚀.在密闭容器中,用压强传感器记录该过程的压强变化,如图所示.下列说法中,不正确的是( )

A. 两容器中负极反应均为Fe-2e-═Fe2+
B. 曲线a记录的是pH=2的盐酸中压强的变化
C. 曲线b记录的容器中正极反应是O2+4e-+2H2O═4OH-
D. 在弱酸性溶液中,生铁能发生吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298 K时,在2 L固定体积的密闭容器中,发生可逆反应:2NO2(g) ![]() N2O4(g) ΔH=-a kJ/mol(a>0)。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,若反应在398 K进行,某时刻测得n(NO2)=0.6 mol,n(N2O4)=1.2 mol,则此时,下列大小关系正确的是( )
N2O4(g) ΔH=-a kJ/mol(a>0)。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,若反应在398 K进行,某时刻测得n(NO2)=0.6 mol,n(N2O4)=1.2 mol,则此时,下列大小关系正确的是( )

A. v(正)>v(逆)
B. v(正)<v(逆)
C. v(正)=v(逆)
D. v(正)、v(逆)大小关系不确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的某溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32﹣、SO32﹣、SO42﹣、Cl﹣、NO3﹣中的一种或几种(忽略水的电离及离子的水解),取该溶液进行连续实验,实验过程如图:下列有关推断不正确的是( )
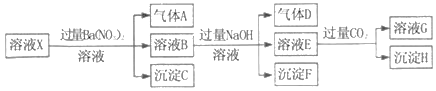
A. 溶液X中一定含有H+、Al3+、NH4+、Fe2+、SO42﹣
B. 根据上述连续实验不能确定溶液X中是否含有Fe3+、Cl﹣
C. 沉淀H为Al(OH)3、BaCO3的混合物
D. 若溶液X为100mL,产生的气体A为44.8mL(标准状况),则X中c(Fe2+)=0.06molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T℃下,分别在三个容积为10L的恒容绝热密闭容器中,发生反应:2CO(g)+SO2(g)![]() S(g)+2CO2(g) ΔH>0,测得相关数据如下表所示。
S(g)+2CO2(g) ΔH>0,测得相关数据如下表所示。
容器 | 起始时物质的量/mol | 平衡时CO2(g)的物质的量/mol | |||
CO(g) | SO2(g) | S(g) | CO2(g) | ||
甲 | 1 | 0.5 | 0.5 | 0 | a |
乙 | 1 | 0.5 | 0 | 0 | 0.8 |
丙 | 2 | 1 | 0 | 0 | b |
下列说法正确的是
A. 其他条件不变,容器乙达到平衡后,再充入体系中四种气体各1mol,平衡逆向移动
B. b=1.6
C. 平衡常数:K甲>K乙
D. 其他条件不变,向容器甲再充入1mol CO,平衡常数(K)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与应用的说法中,均正确的是
A. 氧化铝熔点高,常用于耐高温材料
B. 苏打溶液呈弱碱性,可用作胃酸中和剂
C. 晶体硅熔点高硬度大,可用于制作半导体材料
D. 明矾与水反应生成氢氧化铝胶体,可用于自来水消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氨水中存在电离平衡:NH3·H2O![]() NH4++OH-,下列情况能引起电离平衡向右移动的有( )
NH4++OH-,下列情况能引起电离平衡向右移动的有( )
①加NH4Cl固体 ②加NaOH溶液 ③通HCl ④加CH3COOH溶液 ⑤加水
A. ①③⑤ B. ①④⑤ C. ③④⑤ D. ①②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com