


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.分液、萃取、蒸馏 | B.萃取、蒸馏、分液 |
| C.分液、蒸馏、萃取 | D.蒸馏、萃取、分液 |
查看答案和解析>>
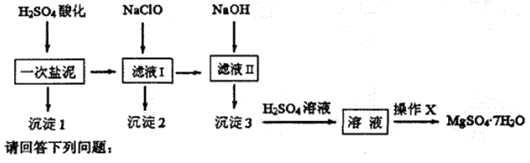
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
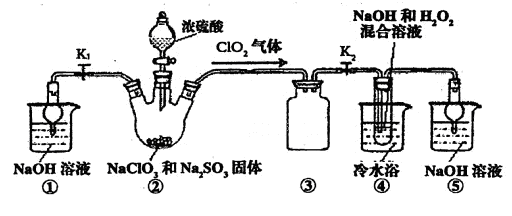
科目:高中化学 来源:不详 题型:单选题
| A.将乙醇与浓硫酸共热制得的气体通入酸性KMnO4溶液中,检验气体中含有乙烯 |
| B.在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去,验证Na2CO3溶液中存在水解平衡 |
| C.淀粉溶液和稀H2SO4混合加热,加入新制Cu(OH)2悬浊液加热至沸腾,检验淀粉水解产物有还原性 |
| D.利用如图装置并根据有关实验现象能推知酸性强弱:CH3COOH>C6H5OH>H2CO3 |
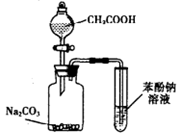
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 NH2COONH4(s) + Q (Q > 0 )
NH2COONH4(s) + Q (Q > 0 ) 
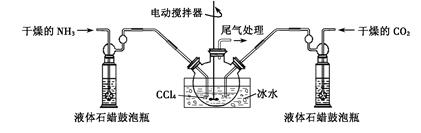
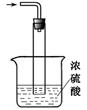
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向其中放入过量镁条,反应完毕后取出 |
| B.蒸馏 |
| C.加入能氧化I2的KMnO4,再分液 |
| D.通入氯气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 物质 | 加入试剂 | 方法 |
| A. | 甲苯(苯酚) | 浓溴水 | 过滤 |
| B. | NaOH(s)(少量NaCl) | 水 | 重结晶 |
| C. | 乙酸乙酯(乙酸) | 乙醇、H2SO4(浓) | 酯化 |
| D. | CO2(CO) | —— | 点燃 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
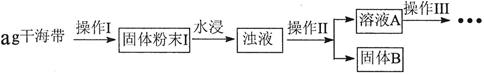
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 取少量稀释后的溶液A加入淀粉后再用硫酸酸化,分装于试管I、II | 无现象 | |
| ② | 往试管I中加入______ | 无现象 | 证明不是以IO3ˉ形式存在 |
| ③ | 往试管II中加入_______ | _______________ | 证明以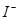 形式存在 形式存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com