
 | 0.600 | 0.500 | 0.400 | 0.300 |
| 318.2 | 3.60 | 3.00 | a | 1.80 |
| 328.2 | 9.00 | 7.50 | 6.00 | 4.50 |
| b | 2.16 | 1.80 | 1.44 | 1.08 |
| A�� | 318.2K��������ʼŨ��Ϊ0.400 mol•L-1��10min������Ũ���Դ���0.376 mol•L-1 | |
| B�� | b Kʱ�������ǵ�Ũ��Ϊ0.35 mol•L-1����v=1.26 mmol•L-1•min-1 | |
| C�� | b��318.2 | |
| D�� | ��ͬʱ�ı䷴Ӧ�¶Ⱥ����ǵ�Ũ�ȣ���v�϶��仯 |
���� A���ɱ���֪�¶���318.2��328.2�棬��Ũ����ͬ�������$\frac{{v}_{318.2}}{{v}_{328.2}}$=0.4��ȷ��a�����ŷ�Ӧ�Ľ��У�������С��
B���ɱ����ݿ�֪��ͬ�¶��£���Ӧ������Ũ�ȳ����ȣ�
C����ͬŨ��ʱ���¶�Խ�ߣ���Ӧ����Խ��
D���ɱ���֪�¶���318.2���b��Ũ����0.3mol/L��0.5mol/L��������ȣ�
��� �⣺A���ɱ���֪�¶���318.2��328.2�棬��Ũ����ͬ�������$\frac{{v}_{318.2}}{{v}_{328.2}}$=0.4����a=0.4��6=2.4���籣�����ʲ��䣬��10min������Ũ�ȵ���0.376 mol•L-1�����ŷ�Ӧ�Ľ��У�������С����10min������Ũ���Դ���0.376 mol•L-1����A��ȷ��
B���ɱ����ݿ�֪��ͬ�¶��£���Ӧ������Ũ�ȳ����ȣ�b Kʱ��������Ũ�ȱ�ֵΪ$\frac{2.16}{0.6}$=3.6����b Kʱ�������ǵ�Ũ��Ϊ0.35 mol•L-1����v=0.35mmol•L-1•min-1��3.6=1.26 mmol•L-1•min-1����B��ȷ��
C����ͬŨ��ʱ���¶�Խ�ߣ���Ӧ����Խ�Ա�318.2��b�����ݿ�֪��b��318.2����C��ȷ��
D���ɱ���֪�¶���318.2���b��Ũ����0.3mol/L��0.5mol/L��������ȣ�����1.80������v���ܲ��䣬��D����
��ѡD��
���� ���⿼����ۺϣ��漰��Ӧ���ʼ��㡢Ӱ�����ʵ����ط����ȣ�����ѧ���������ݷ��������������Ŀ��飬ע�ضԸ߿���Ƶ�����ѵ������Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
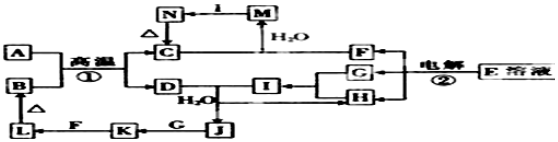
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʯӢ������Ҫ�ɷ��ǹ����� | |
| B�� | ̫���ܵ�ؿɲ��ö������������������Ӧ�������ڻ��������� | |
| C�� | ľ�Ľ����ڹ������Һ���Է����ͷ��� | |
| D�� | ����ʦ����������ʴʯӢ��������Ʒ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ɡ�HF��NH3��ˮ��Һ���ܵ��硱����֪���߾�Ϊ����� | |
| B�� | �ɡ�ij���̷�����ѧ���Ķ��ѡ�����֪�ù��������������� | |
| C�� | �ɡ����������ɲ�ͬ��Ԫ����ɵĴ��������ֻ֪��һ��Ԫ�ص�����һ�����ǻ����� | |
| D�� | �ɡ�ͬ����Ԫ���������ƣ�CO2�ɷ��ӹ��ɡ�������֪SiO2Ҳ�ɷ��ӹ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ͭ���缫��ⱥ��ʳ��ˮ��2Cl-+2H2O$\frac{\underline{\;���\;}}{\;}$2OH-+Cl2��+H2�� | |
| B�� | Fe3O4�������ϡHNO3��Ӧ��Fe3O4+8H+�TFe2++2Fe3++4H2O | |
| C�� | ��Ba��OH��2��Һ����μ���NaHSO4��Һ��Ba2+�պó�����ȫ��Ba2++OH-+H++SO42-�TBaSO4��+H2O | |
| D�� | NaHS��Һ�ʼ��ԣ�HS-+H2O?H3O++OH-+S2- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ��ѧ���� | ʵ��Ӧ�� |
| A | Ũ��������ˮ�� | Ũ����������� |
| B | Cu����FeCl3��Һ��Ӧ | FeCl3��Һʴ��ͭ��·�� |
| C | K2FeO4��ˮ��Ӧ����O2��Fe��OH��3 | K2FeO4����ˮ���������;����� |
| D | �����¸����������������Ӧ | �ø�ƿ����Һ�� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ϩ�ͱ�Ȳ | B�� | ���ȼױ��Ͷ��ȼױ� | ||
| C�� | 2-����������� | D�� | 1-��ϩ��3--��-1-��ϩ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com