
| A. | 常温常压下,氧原子总数为0.2NA的SO2和O2的混合气体,其体积为2.24 L | |
| B. | 0.1mol•L-1的NaHSO4溶液中含有Na+的物质的量为0.1mol | |
| C. | 7.8 gNa2S和7.8 gNa2O2中含有的阴离子数目均为0.1 NA | |
| D. | 标准状况下,22.4 L盐酸含有NA个HCl分子 |
分析 A.不是标况下,不能使用标况下的气体摩尔体积计算;
B.不知道溶液的体积,无法求出硫酸氢钠溶液中的钠离子数目;
C.7.8 gNa2S和7.8 gNa2O2都是$\frac{7.8g}{78g/mol}$=0.1mol,含有的阴离子数目均为0.1 NA;
D.不知道盐酸的浓度,无法求出盐酸中HCl分子.
解答 解:A.不是标况下,不能使用标况下的气体摩尔体积计算,故A错误;
B.不知道溶液的体积,无法求出硫酸氢钠溶液中的钠离子数目,故B错误;
C.7.8 gNa2S和7.8 gNa2O2都是$\frac{7.8g}{78g/mol}$=0.1mol,含有的阴离子数目均为0.1 NA,故C正确;
D.不知道盐酸的浓度,无法求出盐酸中HCl分子,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | X>Y>Z | B. | Y>X>Z | C. | X>Z>Y | D. | Y>Z>X |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
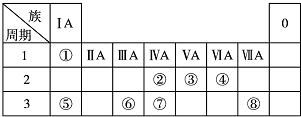
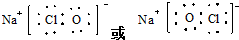 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 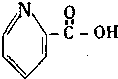 维生素 | B. | 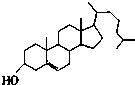 胆固醇 | ||
| C. | 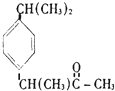 芬必得 | D. | 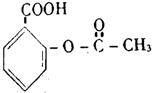 阿斯匹林 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;与甲分子具有相同电子数且含元素种类相同的离子有(填化学式)OH-、H3O+.
;与甲分子具有相同电子数且含元素种类相同的离子有(填化学式)OH-、H3O+.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯使溴水褪色、乙酸乙酯在加热的条件下使含酚酞的NaOH溶液颜色变浅 | |
| B. | 由氯乙烯制聚氯乙烯、由纤维素制硝酸纤维 | |
| C. | 由油脂制甘油、由蛋白质制氨基酸 | |
| D. | 由甲苯制甲基环己烷、由乙烷制溴乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2通入Na2S溶液中,能产生淡黄色沉淀 | |
| B. | HCl的热稳定性比H2S强 | |
| C. | HClO4的酸性比H2SO4强 | |
| D. | HCl的酸性比H2S强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com