
 ;与甲分子具有相同电子数且含元素种类相同的离子有(填化学式)OH-、H3O+.
;与甲分子具有相同电子数且含元素种类相同的离子有(填化学式)OH-、H3O+.分析 X、Y、Z、M四种短周期元素的原子半径依次减小.甲、乙、丙是由它们形成的三种常见分子;甲是人体必需的基本营养物质之一,约占人体体重的2/3,甲为水,可推知M为H元素;丙是具有强氧化性的弱酸,则丙为HClO,乙是日常生活的基础能源,其中含元素Y的质量分数为75%,乙为甲烷,可推知X为Cl、Y为C元素、Z为O元素;丁为丙的钠盐,常用于漂白或消毒,则丁为NaClO;戊与甲的组成元素相同,其分子具有18电子,则戊为H2O2,据此进行解答.
解答 解:X、Y、Z、M四种短周期元素的原子半径依次减小.甲、乙、丙是由它们形成的三种常见分子;甲是人体必需的基本营养物质之一,约占人体体重的2/3,甲为水,可推知M为H元素;丙是具有强氧化性的弱酸,则丙为HClO,乙是日常生活的基础能源,其中含元素Y的质量分数为75%,乙为甲烷,可推知X为Cl、Y为C元素、Z为O元素;丁为丙的钠盐,常用于漂白或消毒,则丁为NaClO;戊与甲的组成元素相同,其分子具有18电子,则戊为H2O2.
(1)元素X、Y的最高价氧化物的水化物分别为:HClO4、H2CO3,非金属性Cl>C,故酸性由强到弱为HClO4>H2CO3;丁为NaClO,电子式为  ;与甲(水)分子具有相同电子数且含元素种类相同的离子有:OH-、H3O+,
;与甲(水)分子具有相同电子数且含元素种类相同的离子有:OH-、H3O+,
故答案为:HClO4>H2CO3; ;OH-;H3O+;
;OH-;H3O+;
(2)元素E、F与X(Cl)同周期.
①常温下E的单质与甲反应缓慢,加热至沸反应迅速,滴加酚酞试液,溶液变红色,则E为Mg,此反应的化学方程式为:Mg+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+H2↑,
故答案为:Mg+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+H2↑;
②F的单质粉末加油漆后即得“银粉漆”,则F为Al,易与氧气反应,与酸、碱反应,保存“银粉”时的注意密封、避免与酸或碱接触;
故答案为:密封;避免与酸或碱接触;
(3)①过氧化氢具有强氧化性,将亚铁离子氧化为铁离子,反应的离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
②过氧化氢在铁离子作催化剂条件下分解生成水与氧气,反应方程式为:2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2O2↑,
故答案为:2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑;
③起始反应即①中使c(H+)降低,且反应②放热,使Fe3++3H2O?Fe(OH)3+3H+△H>0,平衡正向移动,当水解出的Fe(OH)3较多时就聚集为沉淀,
故答案为:起始反应即①中使c(H+)降低,且反应②放热,使Fe3++3H2O?Fe(OH)3+3H+△H>0,平衡正向移动,当水解出的Fe(OH)3较多时就聚集为沉淀.
点评 本题考查元素化合物推断,是对学生综合能力的考查,题目难度中等,涉及元素的推断、物质的电子式、化学式的书写、物质的保存方法、盐的水解及反应现象的描述的知识,需要学生熟练掌握元素化合物知识.


科目:高中化学 来源: 题型:选择题
| A. | 镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 | |
| B. | CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| C. | N2(g)+3H2(g)═2NH3(g)△H<0,升高温度,反应速率v(H2 )和H2的平衡转化率均增大 | |
| D. | 水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏和石油的分馏都属化学变化 | |
| B. | 硫酸钡在医学上用作钡餐,钡离子对人体无害 | |
| C. | 碳-14可用作文物年代的鉴定,碳-14与碳-12互为同素异形体 | |
| D. | 葡萄糖注射液不能产生丁达尔效应现象,不属于胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
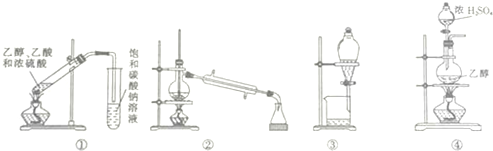
| A. | 装置①可用于实验室制取乙酸乙酯 | |
| B. | 装置②可用于分离苯和甲苯 | |
| C. | 装置③可用于分离碘的四氯化碳溶液 | |
| D. | 装置④可用于实验室制取乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,氧原子总数为0.2NA的SO2和O2的混合气体,其体积为2.24 L | |
| B. | 0.1mol•L-1的NaHSO4溶液中含有Na+的物质的量为0.1mol | |
| C. | 7.8 gNa2S和7.8 gNa2O2中含有的阴离子数目均为0.1 NA | |
| D. | 标准状况下,22.4 L盐酸含有NA个HCl分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 g H2和10 g O2 | B. | 5.6 L N2(标准状况)和22 g CO2 | ||
| C. | 9 g H2O和0.5 mol Br2 | D. | 224 mL H2和0.01 mol N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3是还原剂 | B. | Al被还原 | ||
| C. | Fe2O3发生还原反应 | D. | 反应中转移3个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S、H2O、HF的稳定性依次减弱 | B. | RbOH、KOH、Mg(OH)2的碱性依次增强 | ||
| C. | Na+、Mg2+、Al3+的氧化性依次减弱 | D. | H2SiO3、H2CO3、H2SO4酸性依次增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com