
| A. | 10 g H2和10 g O2 | B. | 5.6 L N2(标准状况)和22 g CO2 | ||
| C. | 9 g H2O和0.5 mol Br2 | D. | 224 mL H2和0.01 mol N2 |
分析 根据N=nNA可知,所含分子数相同,则物质的量相等.
A.根据n=$\frac{m}{M}$计算10g氢气和10g氧气的物质的量关系;
B.根据n=$\frac{V}{{V}_{m}}$计算氮气物质的量,根据n=$\frac{m}{M}$计算二氧化碳的物质的量;
C.根据n=$\frac{m}{M}$计算水的物质的量;
D.未指明氢气所处的状态,不能确定224mL氢气的物质的量.
解答 解:A.根据n=$\frac{m}{M}$可知,10g氢气和10g氧气的物质的量之比为32g/mol:2g/mol=16:1,二者物质的量不相等,含有分子数目不相等,故A错误;
B.标况下,5.6L氮气物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,22g二氧化碳的物质的量为$\frac{22g}{44g/mol}$=0.5mol,二者物质的量不相等,含有分子数目不相等,故B错误;
C.9g水的物质的量为$\frac{9g}{18g/mol}$=0.5mol,与溴的物质的量相同,含有分子数目相等,故C正确;
D.未指明氢气所处的状态,气体摩尔体积不一定是22.4L/mol,不能确定224 mL H2的物质的量,其物质的量不一定为0.01mol,故D错误,
故选C.
点评 本题考查物质的量有关计算,比较基础,注意气体摩尔体积的适用范围及适用条件.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点/℃ | 化学性质 |
| H2C2O4 | 189.5℃ | 二元弱酸,有毒,具有腐蚀性,易溶于水,100℃开始升华,157℃时开始分解,与浓硫酸混合加热会产生CO2、CO和H2O,草酸钙和草酸氢钙均为白色不溶物 |
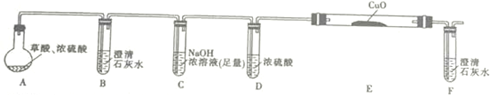
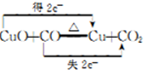 .
.| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | 体积/mL | ||
| Ⅰ | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| Ⅱ | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| Ⅲ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;与甲分子具有相同电子数且含元素种类相同的离子有(填化学式)OH-、H3O+.
;与甲分子具有相同电子数且含元素种类相同的离子有(填化学式)OH-、H3O+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单体CH2═CH2制高聚物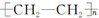 | B. | 单体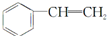 与CH2═CH-CHCH2 与CH2═CH-CHCH2制高聚物 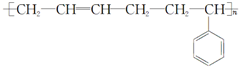 | ||
| C. | 单体CH2═CH-CH3与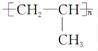 | D. | 单体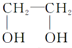 与 与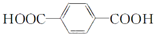 制高聚物 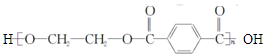 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯使溴水褪色、乙酸乙酯在加热的条件下使含酚酞的NaOH溶液颜色变浅 | |
| B. | 由氯乙烯制聚氯乙烯、由纤维素制硝酸纤维 | |
| C. | 由油脂制甘油、由蛋白质制氨基酸 | |
| D. | 由甲苯制甲基环己烷、由乙烷制溴乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
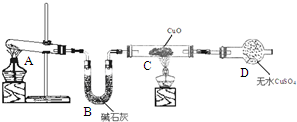 某化学学习小组同学根据实验室现有的制取氨气的药品,设计了如图所示的实验装置(部分夹持仪器未画出),制取并探究氨气的还原性、检验反应产物.请回答下列问题:
某化学学习小组同学根据实验室现有的制取氨气的药品,设计了如图所示的实验装置(部分夹持仪器未画出),制取并探究氨气的还原性、检验反应产物.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
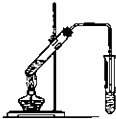 (1)某同学欲用12mol/L的浓盐酸配制1mol/L的盐酸250mL.
(1)某同学欲用12mol/L的浓盐酸配制1mol/L的盐酸250mL.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
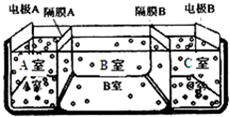 水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:
水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com