
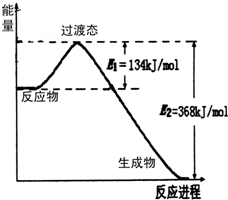
 如图是NO2(g)和CO(g)反应生成CO2(g)和NO(g)过程中能量变化示意图,
如图是NO2(g)和CO(g)反应生成CO2(g)和NO(g)过程中能量变化示意图,

科目:高中化学 来源: 题型:阅读理解
 I.描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb).
I.描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb).| 酸或碱 | 电离平衡常数(Ka或 Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3?H2O | 1.8×10-5 |
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.| 1 |
| 2 |
| 3 |
| 2 |
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
| C4(NO)C6(H2O) |
| C4(NH3)C5(O2) |
| C4(NO)C6(H2O) |
| C4(NH3)C5(O2) |
| 催化剂 |
| 高温高压 |
| 容器 编号 |
起始时各物质的物质的量/mol | 反应达平衡时的焓变/kJ?mol-1 | ||
| N2 | H2 | NH3 | ||
| A | 1 | 3 | 0 | △H1=-23.1 |
| B | 0.9 | 2.7 | 0.2 | △H2 |
查看答案和解析>>
科目:高中化学 来源:巢湖市一中2008-2009学年度第二学期第一次月考高二化学试卷 题型:022
20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态.分析图中信息,回答下列问题:
(1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:________.
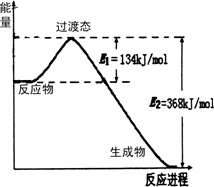
(2)如图表示的是:N2+3H2=2NH3的能量变化情况,写出该反应生成液态氨的热化学方程式:________.
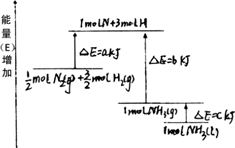
(3)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的ΔH表示生成1 mol产物的数据).根据如图回答下列问题:
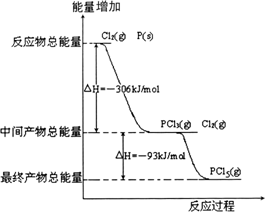
①P和Cl2反应生成PCl3的热化学方程式________.PCl5分解成PCl3和Cl2的热化学方程式________,
②P和Cl2分两步反应生成1 mol PCl5的ΔH3=________,P和Cl2一步反应生成1 mol PCl5的ΔH4________ΔH3(填“大于”、“小于”或“等于”).
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖南省怀化市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
氮氧化物是大气污染物之一,消除氮氧化物的方法有多种。
(1)利用甲烷催化还原氮氧化物。已知:
CH4 (g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)??? △H =-574 kJ/mol
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g)?? △H =-1160 kJ/mol
则CH4 将NO2 还原为N2 的热化学方程式为??????????????????????????????? 。???????
 (2)利用NH3催化还原氮氧化物(SCR技术)。该技术是目前应用最广泛的烟气氮氧化物脱除技术。 反应的化学方程式为:2NH3(g)+NO(g)+NO2(g)
(2)利用NH3催化还原氮氧化物(SCR技术)。该技术是目前应用最广泛的烟气氮氧化物脱除技术。 反应的化学方程式为:2NH3(g)+NO(g)+NO2(g)  ? 2N2(g)+3H2O(g) ΔH < 0
? 2N2(g)+3H2O(g) ΔH < 0
为提高氮氧化物的转化率可采取的措施是????????????????? (写出1条即可)。
(3)利用ClO2 氧化氮氧化物。其转化流程如下:
NO NO2
NO2 N2
N2
已知反应Ⅰ的化学方程式为2NO+ ClO2 + H2O = NO2 + HNO3 + HCl,则反应Ⅱ的化学方程式是?? ????????????? ;若生成11.2 L N2(标准状况),则消耗ClO2 ??????? g 。
(4)利用CO催化还原氮氧化物也可以达到消除污染的目的。
已知质量一定时,增大固体催化剂的表面积可提高化学反应速率。如图是反应2NO(g) + 2CO(g)  2CO2(g)+ N2(g) 中NO的浓度随温度(T)、等质量催化剂表面积(S)和时间(t)的变化曲线。据此判断该反应的△H????? 0 (填“>”、“<”或“无法确定”);催化剂表面积S1????? S2 (填“>”、“<”或“无法确定”)。
2CO2(g)+ N2(g) 中NO的浓度随温度(T)、等质量催化剂表面积(S)和时间(t)的变化曲线。据此判断该反应的△H????? 0 (填“>”、“<”或“无法确定”);催化剂表面积S1????? S2 (填“>”、“<”或“无法确定”)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com