
I.甲醇是一种优质燃料,可制作燃料电池。工业上可用下列两种反应制备甲醇:
已知:CO(g) + 2H2(g) 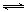 CH3OH(g)
ΔH1
CH3OH(g)
ΔH1
CO2(g) + 3H2(g)
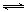 CH3OH(g)
+ H2O(g) ΔH2
CH3OH(g)
+ H2O(g) ΔH2
2H2(g)+ O2(g)=2H2O(g) ΔH3
则2CO(g)+O2(g)=2CO2(g) 的反应热ΔH=____ ___(用ΔH1、ΔH2、ΔH3表示)。
II.工业上可利用“甲烷蒸气转化法生产氢气”,反应为:CH4(g)+H2O(g)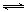 CO(g)+3H2(g)。
CO(g)+3H2(g)。
已知温度、压强和水碳比[n(H2O)/ n(CH4)]对甲烷平衡含量的影响如下图:
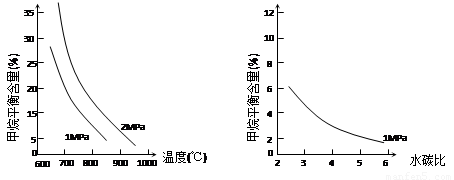
图1(水碳比为3) 图2(800℃)
(1)温度对该反应的反应速率和平衡移动的影响是 。
(2)其他条件不变,请在图2中画出压强为2 MPa时,CH4平衡含量与水碳比之间关系曲线。(只要求画出大致的变化曲线)
(3)已知:在700℃,1MPa时,1mol CH4与1mol H2O在1L的密闭容器中反应,6分钟达到平衡,此时CH4的转化率为80%,求这6分钟H2的平均反应速率和该温度下反应的平衡常数是多少?(写出计算过程,结果保留小数点后一位数字。)
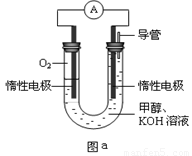
III.某实验小组设计如图a所示的电池装置,正极的电极反应式为____ ____。
(16分)
I.2ΔH1-2ΔH2+ΔH3(3分)
II.(1)其他条件不变,升高温度,反应速率加快,平衡向正反应方向移动。(或描述降温的变化,3分)
(2)如下图(2分)(形状1分,标注1分)

(3)计算过程为:(格式2分,速率1分,常数2分,共5分)
CH4(g)+H2O(g)  CO(g)+3H2(g)
CO(g)+3H2(g)
起始浓度(mol/L) 1 1 0 0
变化浓度(mol/L)0.8 0.8 0.8 2.4
平衡浓度(mol/L)0.2 0.2 0.8 2.4

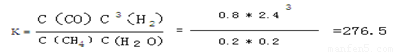
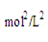
(平衡常数没写单位不扣分)
III.O2 + 2H2O + 4e-=4OH-(3分)
【解析】
试题分析:I.先将4个热化学方程式依次编号为①②③④,再观察、比较后可得:①×2—②×2+③=④,由盖斯定律可知,④的焓变=①的焓变×2—②的焓变×2+③的焓变=2ΔH1-2ΔH2+ΔH3;II.(1)先读图1,发现在1Mpa或2Mpa、600℃~1000℃时,随着温度的升高,甲烷平衡含量均逐渐减小,说明平衡向正反应方向移动;再根据温度对化学反应速率和化学平衡的影响规律,当其他条件不变时,升高温度,反应速率加快,平衡向吸热反应方向或正反应方向移动,则甲烷蒸气转化为氢气的正反应是吸热反应;(2)画图要点:①甲烷蒸气转化为氢气的正反应是气体体积增大的反应,当温度和水碳比保持不变时,增大压强,平衡向气体体积减小方向或逆反应方向移动,则甲烷平衡含量增大,因此2MPa时甲烷平衡含量与水碳比之间关系曲线一定高于1MPa时甲烷平衡含量与水碳比之间关系曲线;②当温度和压强保持不变时,随着水碳比的增大,甲烷平衡含量逐渐减小;(3)依题意可知该可逆反应中各组分起始、变化、平衡浓度,则:
CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
起始浓度(mol/L) 1 1 0 0
变化浓度(mol/L) 0.8 0.8 0.8 2.4
平衡浓度(mol/L) 0.2 0.2 0.8 2.4
根据平均反应速率的定义式,v(H2)=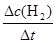 =
=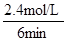 =0.4mol/(L•min)
=0.4mol/(L•min)
根据化学平衡常数的定义式,K= =
= mol2/L2≈276.5
mol2/L2
mol2/L2≈276.5
mol2/L2
III.甲醇燃料电池中正极的主要反应物为氧气,氧元素由0降为—2价,则1个氧气分子得到4个电子,在KOH溶液中只能用氢氧根离子使反应物和产物的电荷守恒,则O2+4e-→4OH-;左边比右边少4个H、2个O原子,根据氢、氧原子个数守恒可知反应物中还有2H2O,则正极反应式为O2 +4e-+2H2O =4OH-。
考点:考查化学反应原理,涉及根据盖斯定律求焓变、根据化学平衡图像得出温度对反应速率和平衡移动的影响规律、根据压强对化学平衡的影响规律画出图像、根据各组分(起始、变化、平衡)浓度模型法计算平均反应速率和平衡常数、碱性甲醇-空气燃料电池的正极反应式等。


 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源: 题型:阅读理解
 (2013?珠海模拟)甲醇是一种优质燃料,可制作燃料电池.
(2013?珠海模拟)甲醇是一种优质燃料,可制作燃料电池.| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省广州六中高二上学期期末考试理科化学试卷(带解析) 题型:填空题
甲醇是一种优质燃料,可制作燃料电池。
(1)工业上可用下列两种反应制备甲醇:
CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
已知:2H2(g)+ O2(g) = 2H2O(g) ΔH3。则2CO(g)+O2(g) = 2CO2(g) 的反应热
ΔH=_____________(用ΔH1、ΔH2、ΔH3表示)。
(2)生产甲醇的原料CO和H2来源于:CH4(g) + H2O(g)  CO(g) + 3H2(g) ΔH4。
CO(g) + 3H2(g) ΔH4。
一定条件下CH4的平衡转化率与温度、压强的关系如图a。则ΔH4______0,P1_________P2
(填“<”、“>”或“=”)
(3)某实验小组设计如图b所示的甲醇燃料电池装置,工作一段时间后,溶液的PH (填增大、减小、不变)。负极的电极反应式为_______ ______。
(4)黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。粗铜电解得到精铜的的电解池中,阳极材料是 ;阴极材料是 ;
阳极泥为:
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省高三上学期期中考试化学试卷(解析版) 题型:填空题
甲醇是一种优质燃料,可制作燃料电池。
(1)为探究用CO2生产燃料甲醇的反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如右图。请回答:

①从反应开始到平衡,氢气的反应速率:v(H2)= 。
②能够说明该反应已达到平衡的是_________。
A.恒温、恒容时,容器内的压强不再变化
B.恒温、恒容时,容器内混合气体的密度不再变化
C.一定条件下,CO、H2和CH3OH的浓度保持不变
D.一定条件下,单位时间内消耗3molH2的同时生成1molCH3OH
③下列措施中能使平衡混合物中n(CH3OH)/n(CO2)增大的是 。
A.加入催化剂 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.降低温度
④求此温度(T1)下该反应的平衡常数K1= (计算结果保留三位有效数字)。
⑤另在温度(T2)条件下测得平衡常数K2,已知T2>T1,则K2 (填“>”、“=”或“<”)K1。
(2)以CH3OH为燃料(以KOH溶液作电解质溶液)可制成CH3OH燃料电池(电池总反应式:2CH3OH+3O2+4OH-=2CO32-+6H2O),则充入CH3OH的电极为 极,充入O2的电极反应式 。
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H1
②2CO(g)+O2(g)=2CO2(g) △H2
则1mol甲醇不完全燃烧生成一氧化碳和气态水时反应的△H= 。(用含△H1、△H2的式子表示)
查看答案和解析>>
科目:高中化学 来源:2014届广东省高二上学期期末考试理科化学试卷(解析版) 题型:填空题
甲醇是一种优质燃料,可制作燃料电池。
(1)工业上可用下列两种反应制备甲醇:
CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
CO2(g) + 3H2(g)
 CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
已知:2H2(g)+ O2(g) = 2H2O(g) ΔH3。则2CO(g)+O2(g) = 2CO2(g) 的反应热
ΔH=_____________(用ΔH1、ΔH2、ΔH3表示)。
(2)生产甲醇的原料CO和H2来源于:CH4(g) + H2O(g)  CO(g) + 3H2(g) ΔH4。
CO(g) + 3H2(g) ΔH4。
一定条件下CH4的平衡转化率与温度、压强的关系如图a。则ΔH4______0,P1_________P2
(填“<”、“>”或“=”)
(3)某实验小组设计如图b所示的甲醇燃料电池装置,工作一段时间后,溶液的PH (填增大、减小、不变)。负极的电极反应式为_______ ______。

(4)黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。粗铜电解得到精铜的的电解池中,阳极材料是 ;阴极材料是 ;
阳极泥为:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com