


分析 原料中加入硫酸酸化,可生成硫酸钙沉淀,减压过滤后加入过氧化氢氧化可生成硫酸铁,加入硫酸铵,在80℃下反应可生成硫酸铁铵,经蒸发浓缩、冷却结晶、过滤洗涤,最后经常温晾晒可到纯净的硫酸铁铵.
(1)硫酸亚铁中亚铁离子水解,硫酸可以已知水解,硫酸根离子可以将钙离子沉淀;
(2)为避免引入新杂质,应加入过氧化氢为氧化剂;过氧化氢与亚铁离子反应生成铁离子和水;
(3)硫酸铁铵经蒸发浓缩、冷却结晶、过滤洗涤,最后经常温晾晒可到纯净的硫酸铁铵,但是温度不能太高;
(4)亚铁离子与铁氰化钾溶液反应生成蓝色沉淀;根据酸性高锰酸钾溶液氧化性很强,可以氧化二价铁和双氧水分析;
(5)依据移液管的正确方法回答,根据元素守恒结合发生的转化来计算即可.
解答 解:原料中加入硫酸酸化,可生成硫酸钙沉淀,减压过滤后加入过氧化氢氧化可生成硫酸铁,加入硫酸铵,在80℃下反应可生成硫酸铁铵,经蒸发浓缩、冷却结晶、过滤洗涤,最后经常温晾晒可到纯净的硫酸铁铵,
(1)加入硫酸,可增大溶液中SO42-浓度,将Ca2+转化为沉淀,生成CaSO4,同时抑制Fe2+水解,
故答案为:增大溶液中SO42-浓度,将Ca2+转化为沉淀或抑制Fe2+水解;
(2)为避免引入新杂质,应加入过氧化氢为氧化剂,还原产物是水,过氧化氢与亚铁离子反应生成铁离子和水,其反应的离子方程式为H2O2+2H++2Fe2+=2Fe3++2H2O,故答案为:b;H2O2+2H++2Fe2+=2Fe3++2H2O;
(3)在80℃下反应可生成硫酸铁铵,经蒸发浓缩、冷却结晶、过滤洗涤,最后经常温晾晒可到纯净的硫酸铁铵,温度不能过高,防止分解,当蒸发皿液面上出现极薄晶膜时,停止加热,故答案为:冷却结晶;常温晾晒;A;
(4)亚铁离子与铁氰化钾溶液反应生成蓝色沉淀,则检验亚铁离子可以用铁氰化钾溶液;酸性高锰酸钾溶液氧化性很强,可以氧化二价铁,也能氧化双氧水,所以不能用酸性高锰酸钾溶液检验是否还有亚铁离子,故答案为:铁氰化钾溶液;不能,因为过氧化氢和二价铁离子均能使酸性高锰酸钾溶液褪色;
(5)移液管的正确使用操作为A和D,称取14.00g样品,将其溶于水配置成100mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到2.14g沉淀,应为Fe(OH)3,n(Fe(OH)3)=$\frac{2.14g}{107g/mol}$=0.02mol,向另一份溶液中加入0.05mol Ba(NO3)2溶液,恰好完全反应,则n(SO42-)=0.05mol,所以14.00g样品中含有Fe2(SO4)30.02mol,n(SO42-)为0.1mol,则(NH4)2SO4为0.1mol-0.02mol×3=0.04mol,则m(H2O)=14.00g-0.02mol×400g/mol-0.04mol×132g/mol=0.72g,n(H2O)=$\frac{0.72g}{18g/mol}$=0.04mol,n(Fe2(SO4)3):n((NH4)2SO4):n(H2O)=0.02:0.04:0.04=1:2:2,所以化学式为Fe2(SO4)3•2(NH4)2SO4•2H2O,故答案为:AD;Fe2(SO4)3•2(NH4)2SO4•2H2O.
点评 本题考查考查物质的分离、提纯制备,为高考常见题型,侧重于学生的分析能力、实验能力和计算能力的考查,注意根据物质的性质把握实验原理和方法,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 少量金属钠保存在煤油里 | |
| B. | 烧碱溶液盛装在使用玻璃塞的试剂瓶中 | |
| C. | 新制氯水通常保存在棕色试剂瓶中 | |
| D. | FeSO4溶液存放在加有少量铁粉的试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 K3[Fe(C2O4)3]•3H2O[三草酸合铁(Ⅲ)酸钾晶体]易溶于水,难溶于乙醇,可作为有机反应的催化剂.实验室可用废铁屑等物质为原料制备,并测定产品的纯度.相关反应的化学方程式为:
K3[Fe(C2O4)3]•3H2O[三草酸合铁(Ⅲ)酸钾晶体]易溶于水,难溶于乙醇,可作为有机反应的催化剂.实验室可用废铁屑等物质为原料制备,并测定产品的纯度.相关反应的化学方程式为:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某小组以工业氧化铁、草酸、盐酸、异丙醚为原料,合成晶体X[化学式为Fe2(C2O4)3•5H2O],并确定其纯度.
某小组以工业氧化铁、草酸、盐酸、异丙醚为原料,合成晶体X[化学式为Fe2(C2O4)3•5H2O],并确定其纯度.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素原子的原子半径出现周期性变化 | |
| B. | 元素的化合价出现周期性变化 | |
| C. | 元素原子的电子层数出现周期性变化 | |
| D. | 元素原子的核外电子排布出现周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
. (或
(或 、
、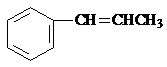 ).
).
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com