
【题目】如图是一种钠硫高能电池的结构示意图,M由Na2O和Al2O3制得,其作用是导电和隔膜,该电池反应为2Na+xS=Na2Sx . 该电池正极的电极反应式为 .
用该电池作电源进行铁件镀铜时,若电镀池中两电极的质量开始相同,电镀完成后取出洗净、烘干、称量,二者质量差为25.6g,则理论上该电池负极消耗的质量为g.
【答案】xS+2e﹣=Sx2﹣;9.2
【解析】解:原电池正极发生得电子的还原反应,在反应2Na+xS=Na2Sx中,硫单质得电子,故正极反应为:xS+2e﹣=Sx2﹣;电镀时,镀层作阳极、镀件作阴极,所以阳极上铜失电子发生氧化反应,电极反应式为Cu﹣2e﹣=Cu2+ , 阴极上铜离子得电子发生还原反应,阴极反应式为Cu2++2e﹣=Cu;电镀后,两个电极质量差等于阳极溶解质量与阴极析出质量之和,若电镀前铁、铜两电极的质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为25.6g,所以阳极溶解铜的质量为12.8g,
设通过的电子为x,
Cu | ﹣ | 2e﹣ | =Cu2+ |
64g | 2mol | ||
12.8g | x |
64g:2mol=12.8g:x,
x=0.4mol,
故流经电镀池的电极的电子的物质的量为0.4mol,而流经电镀池的电子的量与流经原电池中正负极的电子的量相同,设原电池负极上有Xg钠被消耗,有:
Na | ﹣ | e﹣ | =Na+ |
23g | 1mol | ||
Xg | 0.4mol |
可得 X= ![]()
解得X=9.2g
所以答案是:xS+2e﹣=Sx2﹣;9.2.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
【题目】黄铜矿的主要成分是CuFeS2(硫元素﹣2价,铁元素+2价).实验室用黄铜矿为原料制取单质铜和铁红(Fe2O3)的流程如图: 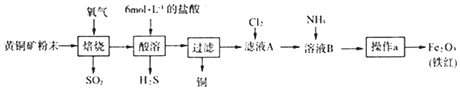
已知:CuFeS2+O2 ![]() Cu+FeS+SO2 FeS+2HCl=FeCl2+H2S↑
Cu+FeS+SO2 FeS+2HCl=FeCl2+H2S↑
(1)实验室制氯气的化学方程式为 .
(2)SO2和H2S有毒,会造成大气污染.
①已知SO2和H2S混合可以得到单质硫.为使SO2和H2S恰好完全转化为硫,二者体积(标准状况)比应为 .
为检验某尾气中是否含有SO2、CO2、CO三种气体,实验小组同学用如下装置设计实验.
选择上述装置(可以重复),按照气流方向其连接顺序为A→(填序号).
(3)PbO2具有强氧化性,可与浓盐酸反应制取氯气.
①上述反应化学方程式为;由PbO与次氯酸钠溶液反应可制得PbO2 , 反应的离子方程式为 .
②Cl2是纺织工业中常用的漂白剂,Na2S2O3可作漂白布匹后的“脱氯剂”.Na2S2O3在溶液中被Cl2氧化成SO42﹣ , 则该反应的化学方程式为 .
③本实验存在的一个缺陷是 .
(4)按上述流程用150g黄铜矿粉末可制得48gFe2O3(铁红),则该黄铜矿中含CuFeS2的质量分数是(假设各步反应均完全进行且过程中无额外物质损耗).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组用如图1所示装置进行实验,请回答下列问题: 
(1)若开始实验时开关K与a连接,则B极的电极反应式为 .
(2)若开始实验时开关K与b连接,则下列说法正确的是(填序号). ①溶液中Na+向A极移动
②从A极逸出的气体能使湿润的淀粉KI试纸变蓝
③反应一段时间后向电解液中加适量盐酸可恢复到电解前的浓度
(3)该小组运用工业上离子交换膜法制烧碱的原理,用如图2所示装置电解K2SO4溶液. ①该电解槽的阳极反应式为 , 通过阴离子交换膜的离子数(填“>”、“<”或“=”)通过阳离子交换膜的离子数;
②图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为;
③电解一段时间后,B口与C口产生气体的质量比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属M在酸性或碱性溶液中均可与HNO3发生氧化还原反应,转化关系如图(部分生成物未列出): 
已知:C、D、E、G均为气体,且G为单质;将D通入A溶液产生白色沉淀;将F逐滴加入B溶液至过量,先产生白色沉淀,随后沉淀消失.
请回答下列问题:
(1)写出下列物质的化学式:M、F、G .
(2)A溶液与B溶液混合也能产生白色沉淀,写出该反应的离子方程式 .
(3)除去气体C中的气体E的化学方法是 .
(4)将10mL充满气体E和O2混合气的试管倒扣在水槽中,反应后试管中残留1mL无色气体,则试管中气体E的体积是mL
(5)D→C反应的化学方程式是 .
(6)M与NO3﹣在碱性条件下反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某有机化合物A的结构,进行如下实验:
(1)分子式的确定 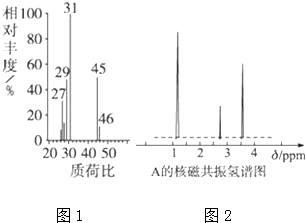
(i)将有机物A置于氧气流中充分燃烧实验测得:碳的质量分数为52.16%,氢的质量分数为13,.14%,则该物质中各元素的原子个数比是
(ii)用质谱仪测定其相对分子质量,得到如图1所示的质谱图,则该有机物A的相对分子质量为 , 分子式为
(iii)根据价键理论,预测A的可能结构并写出结构简式
(2)结构式的确定 核磁共振氢谱能对有机物分子中不同位置的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目经测定,有机物A的核磁共振氢谱示意图如图2所示,则A的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应).请回答下列问题: 
(1) A、B中的反应物分别是浓盐酸和MnO2 . 写出所发生的化学方程式 , 进入装置C的气体中所含杂质是、 .
【答案】MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O| HCl| H2O
MnCl2+Cl2↑+2H2O| HCl| H2O
(1)A、B中的反应物分别是浓盐酸和MnO2 . 写出所发生的化学方程式 , 进入装置C的气体中所含杂质是、 .
(2)漂白粉的有效成分是(填化学式);D中所发生的化学反应的离子方程式是 .
(3)此实验所得漂白粉的Ca(ClO)2产率偏低.该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应: ①温度较高时氯气与消石灰反应生成Ca(ClO3)2 , 为避免此副反应的发生,可采取的措施是
②为避免另一副反应的发生,应采取的措施是 .
(4)若将该实验中残留的Cl2 , 缓慢通入KI溶液至过量,则溶液先变黄后变无色,且可检测到HIO3;写出并配平该“变无色”反应的化学方程式:5Cl2+I2+→若将KI改为KBr溶液,则溶液变为色,未检测到HBrO3的存在.由上述事实推测,Cl2、HIO3、HBrO3的氧化性由强到弱的次序是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 元素周期表中元素排序的依据是元素的相对原子质量
B. 阴、阳离子通过静电引力形成离子键
C. 元素周期表有十八个纵行,也就是十六个族
D. 只有在活泼金属元素和活泼非金属元素化合时,才能形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室中进行如下实验:
编号 | Ⅰ | Ⅱ | Ⅲ |
实验 |
|
|
|
现象 | 没有明显变化,溶液仍为无色 | 有白色沉淀生成,溶液为蓝色 | 有无色气体放出 |
以下结论正确的是( )
A.Ⅰ中无明显变化,说明两溶液不反应
B.Ⅱ中的白色沉淀为CuCl2
C.Ⅲ中的离子方程式为2H++Zn=Zn2++H2↑
D.Ⅲ中发生的反应不是离子反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com