
今有碱金属的两种碳酸盐和碱土金属(Mg、Ca等二价金属)的一种不溶性碳酸盐组成的混合物。取7.560 g该混合物与过量盐酸完全反应,放出CO2体积为1.344 L(标准状况)。另取等质量的原混合物加水搅拌,可滤出不溶性盐1.420 g。取过滤后滤液的![]() 体积,向其中缓慢滴加浓度为0.2500 mol/L的盐酸,并同时记录放出的CO2的体积(标准状况)和消耗盐酸的体积,得到如图所示的曲线。通过计算,确定这两种碱金属碳酸盐的化学式。
体积,向其中缓慢滴加浓度为0.2500 mol/L的盐酸,并同时记录放出的CO2的体积(标准状况)和消耗盐酸的体积,得到如图所示的曲线。通过计算,确定这两种碱金属碳酸盐的化学式。
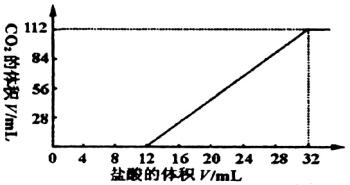
(1)按图分析,碱金属碳酸盐中: n(CO n(HCO 由滤出的1.420 g不溶物(碱土金属难溶盐)可计算出两种碱金属碳酸盐的质量为: 7.56-1.42=6.14(g)。 (2)设碱金属的两种碳酸盐中碱金属元素的相对原子质量为x和y,则: (2x+60)×0.03+(y+61)×0.02=6.14, (2y+60)×0.03+(x+61)×0.02=6.14。 经整理,得:2x+y=156,x+3y=156。 显然,x=y,解之,x=y=39。此相对原子质量是钾元素的数据,不可能是其他碱金属(Li、Na、Rb、Cs、Fr)。 (3)所以两种碱金属的碳酸盐,一种为K2CO3(0.03 mol),另一种为KHCO3(0.02 mol)。
|
7.560 g混合物与足量盐酸反应后放出1.344 L CO2,可知总的混合物中碳酸盐的物质的量为:n=1.344/22.4=0.06(mol)。 由图分析知,开始加盐酸时并未放出CO2,至加到12 mL盐酸后才逸出CO2,可见加入12 mL盐酸之前反应为:H++CO 其后,由加12 mL至32 mL(共20 mL)盐酸均有 据此,由前12 mL耗酸量可求出碱金属碳酸盐的物质的量,由总
|


科目:高中化学 来源:物理教研室 题型:022
(1)取过滤后液体体积的1/10,向其中缓慢滴加浓度为0.2500mol·L-1的盐酸,并同时记录放出的CO2体积(标准状况)和消耗盐酸的体积,得到如图的曲线,确定这两种碱金属碳酸盐的化学式.
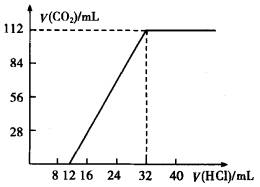
(2)将滤出的不溶性碳酸盐(1.420g)投入到浓度为2.500mol·L-1的盐酸中,当完全反应时耗去盐酸16.00mL.试计算确定原不溶性碳酸盐的化学式.
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:022
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:038
查看答案和解析>>
科目:高中化学 来源: 题型:
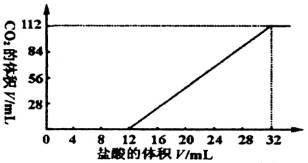
今有碱金属的两种碳酸盐组成的混合物6.14g,加水溶解后,取所得溶液的十分之一,向其中缓慢滴加一定浓度的盐酸,并同时记录放出CO2的体积(标准状况)和消耗盐酸的体积,得到右图所示的曲线。试计算:
(1)混合物中碳元素的质量分数。
(2)所滴加盐酸的物质的量浓度。
(3)确定这两种碱金属碳酸盐的化学式。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com