
【题目】某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某化学兴趣小组对其组成进行探究。完成下列空格。
①提出假设:
假设1:只存在Fe2O3;假设2:_________;假设3:既存在Fe2O3也存在Cu2O。
②查找资料:Cu2O在酸性溶液中会发生反应:Cu2O+2H+=Cu+Cu2++H2O。
③实验方案设计与分析:
方案一:步骤一:取少量样品于烧杯中,加入过量浓硝酸,产生一种红棕色的气体。由此可得出假设____不成立,写出产生上述气体的化学方程式___________________。
步骤二:取少量步骤一溶液置于试管中滴加_______,振荡,若________,则说明假设3成立。
方案二:
取少量样品于烧杯中,加入过量稀硫酸,若固体全部溶解,说明假设_不成立。
方案三:

同学们设计了如下实验方案测定该样品中Fe2O3的质量分数(装置气密性良好,假设样品完全反应):
步骤一:取样品并称量该样品的质量为m1;
步骤二:测出反应前广口瓶和瓶内物质总质量m2;
步骤三:测出反应后广口瓶和瓶内物质总质量m3;
步骤四:计算得出矿物样品中Fe2O3的质量分数。
讨论分析:该实验方案________(填“能”或“不能”)测出矿物中Fe2O3的质量分数。不改变装置和药品,通过计算得出矿物中Fe2O3的质量分数,你还可以通过测定_______。若测得m1为3.04g,m3=m2+1.76g,则原样品中Fe2O3的质量分数为_____(结果保留四位有效数字)。
【答案】 只存在Cu2O 1Cu2O+6HNO3(浓)=2Cu(NO3)2+2NO2↑+3H2O KSCN溶液 溶液显红色 2 能 测量反应后固体的质量或广口瓶中沉淀的质量。(其他合理答案也给分) 52.63%
【解析】试题分析:本题为化学实验探究题,为高考题的常见题型,题目难度较大。解答本题要结合题给信息和铁、铜及其化合物的性质作出预测、分析判断。
解答:①提出假设:根据题给信息:红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种和假设1和假设3知假设2为:只存在Cu2O。
③实验方案设计与分析:方案一:步骤一:样品与过量浓硝酸反应产生红棕色的NO2气体,硝酸发生了还原反应,Fe2O3中铁元素为+3价,只有氧化性,Cu2O中铜元素为+1价,既有氧化性又有还原性,则红色粉末中一定含有Cu2O,由此可得出假设1不成立,Cu2O与浓硝酸反应生成硝酸铜、二氧化氮和水,化学方程式为1Cu2O+6HNO3(浓)=2Cu(NO3)2+2NO2↑+3H2O;若要证明假设3成立,则需要证明铁元素的存在,故步骤二为取少量步骤一溶液置于试管中滴加KSCN溶液,振荡,若溶液显红色,则说明假设3成立。
方案二:根据信息②Cu2O+2H+=Cu+Cu2++H2O知取少量样品于烧杯中,加入过量稀硫酸,若固体全部溶解,说明假设2不成立。
方案三:该实验方案的原理为Fe2O3 + 3CO![]() 2Fe+3CO2、Cu2O + CO
2Fe+3CO2、Cu2O + CO![]() 2Cu+CO2,CO2+Ca(OH)2==CaCO3↓+H2O,通过测定反应前混合物的质量,反应前后广口瓶和瓶内物质总质量的差值,确定二氧化碳的质量,列方程组求解,能测出矿物中Fe2O3的质量分数;也可通过测量反应后固体的质量或广口瓶中沉淀的质量,列方程组求解,确定矿物中Fe2O3的质量分数;若测得m1为3.04g,m3=m2+1.76g,则生成CO2的质量为1.76g,物质的量为0.04mol,根据氧原子守恒知混合物中氧原子的物质的量为0.04mol。设混合物中Fe2O3的物质的量为x,Cu2O的物质的量为y,则有①160g/molx+144g/moly=3.04g(质量守恒),②3x+y=0.04mol(氧原子守恒),联立①②解得x=0.01mol,y=0.01mol,则混合物中Fe2O3的质量为1.60g,则原样品中Fe2O3的质量分数为1.60g/3.04g×100%=52.63%。
2Cu+CO2,CO2+Ca(OH)2==CaCO3↓+H2O,通过测定反应前混合物的质量,反应前后广口瓶和瓶内物质总质量的差值,确定二氧化碳的质量,列方程组求解,能测出矿物中Fe2O3的质量分数;也可通过测量反应后固体的质量或广口瓶中沉淀的质量,列方程组求解,确定矿物中Fe2O3的质量分数;若测得m1为3.04g,m3=m2+1.76g,则生成CO2的质量为1.76g,物质的量为0.04mol,根据氧原子守恒知混合物中氧原子的物质的量为0.04mol。设混合物中Fe2O3的物质的量为x,Cu2O的物质的量为y,则有①160g/molx+144g/moly=3.04g(质量守恒),②3x+y=0.04mol(氧原子守恒),联立①②解得x=0.01mol,y=0.01mol,则混合物中Fe2O3的质量为1.60g,则原样品中Fe2O3的质量分数为1.60g/3.04g×100%=52.63%。


科目:高中化学 来源: 题型:
【题目】25 ℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是( )
A. c(SO42-)>c(NH4+)>c(H+)=c(OH-) B. c(NH4+)=2c(SO42-)
C. c(NH4+)+c(NH3·H2O)=2c(SO42-) D. c(OH-)+c(SO42-)=c(H+)+c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度时,将n molL-1氨水滴入10mL1.0 molL-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如右图所示,下列有关说法正确的是( )
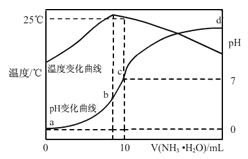
A. a点Kw=1.0×10-14
B. 水的电离程度:b>c>a>d
C. b点:C(NH4+)>C(Cl-)>C(H+)>C(OH-)
D. 25℃时NH4Cl水解常数为(n-1)×10-7molL-1(用n表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化物按其溶解性可以分三类:①易溶于水的有K2S,Na2S,(NH4)2S等;②易溶于非氧化性强酸,不溶于水的有FeS,ZnS等;③大部分的硫化物既不溶于水也不溶于非氧化性强酸,如HgS,Ag2S,CuS,Cu2S等。其中,Ag2S,CuS,Cu2S能溶于硝酸发生氧化还原反应,而HgS只能溶于王水。
(1)推测硫化氢通入硫酸铜溶液中能否发生反应?若能,写出反应的离子方程式;若不能,写出原因 。
(2)在氢硫酸溶液中改变下列条件,能使溶液中c(OH-)、c(S2-)都增大的是 。
A.加入少量的漂白粉 B.通入氨气
C.加入少量过氧化钠粉末 D.加入少量硝酸银溶液
(3)已知在常温下,FeS的Ksp=6.25×10-18,H2S饱和溶液中c(H+)与c(S2-)之间存在如下关系:c2(H+)·c(S2-)=1.0×10-22。在该温度下,将适量FeS投入硫化氢饱和溶液中,欲使溶液中c(Fe2+)达到1 mol·L-1,应调节溶液的pH为____________(已知lg2=0.3)。
(4)将Hg加入到一定浓度的H2S溶液中,有氢气产生,原因为 。
(已知Hg在溶液中,存在平衡:Hg-2e—![]() Hg2+)
Hg2+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是:
A. 共价化合物中可能含有离子键
B. 区别离子化合物和共价化合物的方法是看其水溶液是否能够导电
C. 离子化合物中只含有离子键
D. 离子化合物在熔融状态下能电离出自由移动的离子,而共价化合物不能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 物质不是电解质就是非电解质
B. 酸性氧化物不一定都是非金属氧化物,而非金属氧化物一定是酸性氧化物
C. 能导电的物质不一定是电解质,电解质也不—定能导电
D. 液氨溶于水能导电,所用是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定条件下,向容积为2L的恒容密闭容器中充入1 mol CH3OH(g)和3 mol H2O(g),CH3OH(g) + H2O(g)![]() CO2(g) + 3H2(g)
CO2(g) + 3H2(g) ![]() H(298K)=+ 49.4 kJ/mol。实验测得:达到平衡状态时,吸收热量19.76 kJ。则
H(298K)=+ 49.4 kJ/mol。实验测得:达到平衡状态时,吸收热量19.76 kJ。则
①达平衡时混合气体的压强是反应前的 倍。
②该条件下反应达平衡状态的依据是(填序号) 。
A.v正(CH3OH)=v正(CO2) B.混合气体的密度不变
C.c(CH3OH)=c(H2O) D.混合气体的总物质的量不变
(2)在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热Q kJ。则表示甲醇燃烧热的热化学方程式为_____________________。
(3)对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
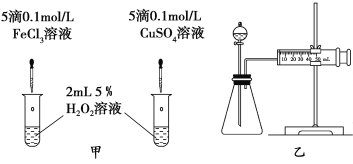
①定性分析:如图甲可通过观察__________________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是___________。
②定量分析:用图乙所示装置做对照实验,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。检查该装置气密性的方法是 ,实验中需要测量的数据是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016-2017学年辽宁省重点高中协作校高二上学期期中化学卷】电离度是描述弱电解质电离程度的物理量,电离度=(己电离的物质的量/原来的总物质的量)X 100%。现取20 mL pH=4的CH3COOH溶液,加入0.2 mol L-1的氨水,测得溶液导电性变化如下图,则加入氨水前CH3COOH的电离度为
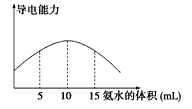
A.0.5% B.0.1% C.1.5% D.1%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应与能量的说法正确的是 ( )
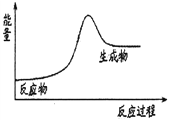
A. 放热反应在常温下一定很容易发生
B. 化学反应一定既伴随着物质变化又伴随着能量变化
C. 石灰石分解反应的能量变化可以用右图3表示
D. 反应物所具有的总能量高于生成物所具有的总能量的反应为吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com