
(9分)研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,也可用NH3处理,也可用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
若用标准状况下2.24L CH4还原NO2至N2整个过程中转移的电子总数为______(阿伏加德罗常数的值用NA表示),放出的热量为______kJ。
(2)已知:2SO2(g)+O2(g) 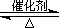 2SO3(g) ?H="-196.6" kJ·mol-1
2SO3(g) ?H="-196.6" kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ?H="-113.0" kJ·mol-1
2NO2(g) ?H="-113.0" kJ·mol-1
(ⅰ)则反应NO2(g)+SO2(g) SO3(g)+NO(g)的?H= kJ·mol-1。
SO3(g)+NO(g)的?H= kJ·mol-1。
(ⅱ)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
A.每消耗1 mol SO3的同时生成1 mol NO2 B. 体系压强保持不变
C. 混合气体颜色保持不变 D. SO3和NO的体积比保持不变
(ⅲ)某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图(左)所示。平衡状态由A变到B时.平衡常数K(A)_______K(B)(填“>”、“<”或“=”)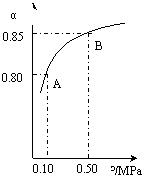
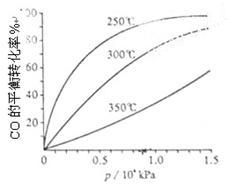
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如上图(右)所示。该反应?H 0(填“>”或“ <”)。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如上图(右)所示。该反应?H 0(填“>”或“ <”)。
0.8NA 86.7 (2)(ⅰ)-41.8(ⅱ)C(ⅲ)=(3) <
解析试题分析:(1)、反应①+②得2CH4+4NO2=2CO2+2N2+4H2O,?H=-1734 kJ·mol-1,当消耗2molCH4时转移电子16mol,故当消耗0.1mol(2.24L)CH4时,转移电子0.8mol,即0.8NA 放出热量为86.7KJ;(2)、ⅰ:(①-②)/2,得SO2+NO2 SO3+NO,?H=-41.8 kJ·mol-1ⅱ:这是一个反应前后体系压强不变的反应,故B错,A项无论平衡与否每消耗1 mol SO3的同时必生成1 mol NO2,错 D项二者的比例永远为1:1.ⅲ:平衡常数只与温度有关;(3)、温度越高,CO的转换率越低,平衡向逆向移动,故该反应为放热反应,?H<0
SO3+NO,?H=-41.8 kJ·mol-1ⅱ:这是一个反应前后体系压强不变的反应,故B错,A项无论平衡与否每消耗1 mol SO3的同时必生成1 mol NO2,错 D项二者的比例永远为1:1.ⅲ:平衡常数只与温度有关;(3)、温度越高,CO的转换率越低,平衡向逆向移动,故该反应为放热反应,?H<0
考点:化学反应与能量,化学平衡
点评:本题结合化学反应与能量、化学平衡来综合考察学生对基础知识的掌握以及处理信息的能力。从计算角度来说,难度不大,关键是对每一个小题的知识点要掌握熟练,同时需要学生对平衡图像的处理能力。


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
 (2011?山东)研究NO2、SO2、CO等大气污染气体的处理有重要意义.
(2011?山东)研究NO2、SO2、CO等大气污染气体的处理有重要意义.| 催化剂 | △ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
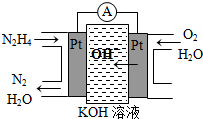 Ⅰ.肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
Ⅰ.肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题| 物质 | CO | H2 | CH3OH |
| 浓度(mol?L-1) | 0.9 | 1.0 | 0.6 |
| 2 |
| 3 |
| 2 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 加热 |
| 8 |
| 3 |
| 8 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.| 催化剂 | 加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com