
【题目】实验室配制500 mL 0.2 mol/L的Na2SO4溶液,实验操作步骤有:
A.在天平上称出14.2 g硫酸钠固体,把它放在烧杯中,用适量的蒸馏水使它完全溶解并冷却至室温。
B.把制得的溶液小心地转移到容量瓶中。
C.继续向容量瓶中加蒸馏水至液面距刻度线1~2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面最低处与刻度线相切。
D.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心注入容量瓶,并轻轻振荡。
E.将容量瓶瓶塞塞紧,充分摇匀。
请填写下列空白:
(1)操作步骤的正确顺序为(填序号)________。
(2)本实验用到的基本仪器已有烧杯、天平(带砝码、镊子)、玻璃棒,还缺少的仪器是 _______、_______、 _______。
(3)下列情况会使所配溶液浓度偏高的是(填序号)______。
a.没进行上述的操作步骤D
b.加蒸馏水时,不慎超过了刻度线
c.砝码上沾有杂质
d.容量瓶使用前内壁沾有水珠
【答案】ABDCE 药匙 胶头滴管 500mL容量瓶 c
【解析】
(1)根据配制溶液的实验操作过程进行操作步骤的排序;
(2)根据配制溶液的实验操作过程选择所用仪器;
(3)分析操作对溶质的物质的量或对溶液的体积的影响,根据c=![]() 分析判断。
分析判断。
(1)操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,用托盘天平称量,用药匙取药品,在烧杯中溶解(可用量筒加水),用玻璃棒搅拌,加速溶解,恢复到室温后转移到500mL容量瓶中,并用玻璃棒引流,洗涤2~3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线12cm时,改用胶头滴管滴加,最后定容颠倒摇匀。所以操作顺序为:ABDCE,故答案为:ABDCE;
(2)由(1)中操作可知,所用仪器有:托盘天平、500mL容量瓶、烧杯、玻璃棒、胶头滴管、药匙等。故还缺少的仪器是:药匙、胶头滴管、500mL容量瓶,
故答案为:药匙;胶头滴管;500mL容量瓶;
(3)a.没有洗涤烧杯和玻璃棒,烧杯壁与玻璃棒上沾有少量硫酸钠,移入容量瓶内的硫酸钠的实际质量减小,所配溶液浓度偏低,a项错误;
b.加蒸馏水时,不慎超过了刻度线,所配溶液体积偏大,溶液浓度偏低,b项错误;
c.砝码上沾有杂质,实际称量的硫酸钠的增大,所配溶液浓度偏高,c项正确;
d.定容需要加水,容量瓶使用前内壁沾有水珠,对所配溶液浓度无影响,d项错误;
故选c。


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组以废铁屑制得硫酸亚铁铵后,按下列流程制备二水合草酸亚铁(![]() ),进一步制备高纯度还原铁粉。
),进一步制备高纯度还原铁粉。
已知:![]() 难溶于水;
难溶于水;![]() 是二元弱酸,溶于水。
是二元弱酸,溶于水。
(1)步骤②中H2C2O4稍过量的目的是:_____________________;
(2)步骤②中得到FeC2O4.2H2O的离子反应方程式为:_________________________。
(3)实现步骤④,必须在 ______(填仪器名称)中进行,该步骤发生的化学反应方程式为:______________
(4)为实现步骤⑤,不宜用碳粉直接还原Fe2O3,理由是________________________。
(5)若将固体![]() 放在一个可称出质量的容器内加热,
放在一个可称出质量的容器内加热,![]() ( Mr=180)首先逐步失去结晶水,温度继续升高时.
( Mr=180)首先逐步失去结晶水,温度继续升高时.![]() (Mr=144)会逐渐转变为铁的各种氧化物。称取18.00g
(Mr=144)会逐渐转变为铁的各种氧化物。称取18.00g![]() ,持续加热,剩余固体的质量随温度变化的部分数据如下表(其中450℃以前是隔绝空气加热,450℃以后是在空气中加热):
,持续加热,剩余固体的质量随温度变化的部分数据如下表(其中450℃以前是隔绝空气加热,450℃以后是在空气中加热):
温度/℃ | 25 | 150 | 300 | 350 | 400 | 450 | 500 | 600 | 700 | 800 |
固体质量/g | 18.00 | 16.20 | 14.40 | 14.40 | 7.20 | 7.20 | 8.00 | 8.00 | 7.73 | 7.73 |
根据上述数据计算并推断:150℃剩余的固体物质是________________(填化学式,下同);800℃剩余的固体物质是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MoS2(辉钼矿的主要成分)可用于制取钼的化合物润滑添加剂氢化反应和异构化反应的催化剂等。回答下列问题:
(1)反应3MoS2+18HNO3+12HCl=3H2[MoO2Cl4]+18NO↑+6H2SO4+6H2O中,每溶解1mol MoS2,转移电子的物质的量为___________。
(2)已知:MoS2(s)= Mo(s)+S2(g) △H1
S2(g)+2O2(g)=2SO2(g) △H2
2MoS(s)+7O2(g)=2MoO3 (s)+4SO2(g) △H3
反应2Mo(s)+3O2(g)=2MoO3(s)的△H=___________(用含△H1、△H2、△H3的代数式表示)。
(3)利用电解法可浸取辉钼矿得到Na2MoO4和Na2SO4溶液(装置如图所示)。

①阴极的电极反应式为______________________。
②一段时间后,电解液的pH___________ (填“增大”“减小”或“不变”),MoO42-在电极___________(填“A”或“B”)附近生成。
③实际生产中,惰性电极A一般不选用石墨,而采用DSA惰性阳极(基层为TiO2,涂层为RuO2+IrO2),理由是_______________________。
(4)用辉钼矿冶炼Mo的反应为
MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) △H。
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) △H。
①该反应的△H___________(填“>”或“<”)0;p1、p2、p3按从小到大的顺序为___________。
②在某恒容密闭容器中加入0.1 mol MoS2、0.2mol Na2CO3、0.4mol H2,一定温度下发生上述反应,下列叙述说明反应已达到平衡状态的是____________ (填标号)。
a.v正(H2)=v逆(CO)
b.气体的密度不再随时间变化
c.气体的压强不再随时间变化
d单位时间内断裂H一H键与断裂H—O键的数目相等
③在2L的恒温恒容密闭容器中加入0.1 mol MoS2、0.2 mol Na2CO3、0.4molH2,在1100K时发生反应,达到平衡时恰好处于图中A点,则此温度下该反应的平衡常数为___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如表:
温 度(℃) | 360 | 440 | 520 |
K值 | 0.036 | 0.010 | 0.0038 |
(1)①由上表数据可知该反应为_____ (填放热,吸热,无法确定 )反应。
②下列措施能用勒夏特列原理解释是_____(填序号)。
a.增大压强有利于合成氨 b.使用合适的催化剂有利于快速生成氨
c.生产中需要升高温度至500°C左右 d.需要使用过量的N2,提高H2转化率
(2)0.2mol氨气溶于水后再与含有0.2mol硫酸的溶液反应放热QkJ,请你用热化学方程式表示其反应式_____。
(3)常温时,将amol氨气溶于水后,再通入bmol氯化氢,溶液体积为1L,且c(NH4+)=c(Cl﹣),则一水合氨的电离平衡常数Kb=_____(用ab表示)。
(4)原料气H2可通过反应 CH4(g)+H2O (g)![]() CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的![]() 恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:

①图中,两条曲线表示压强的关系是:P1_____P2(填“>”、“=”或“<”)。
②其它条件一定,升高温度,氢气的产率会__(填“增大”,“减小”减小,“不变”不变)。
(5)原料气H2还可通过反应CO(g)+H2O(g)![]() CO2(g)+H2(g)获取。
CO2(g)+H2(g)获取。
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08molL﹣1,该温度下反应的平衡常数K值为_____。
②保持温度仍为T℃,容积体积为5L,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是_____(填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应aA(s)+bB(g)![]() cC(g) +dD(g) △H= Q ,反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如图所示据图分析,以下正确的是
cC(g) +dD(g) △H= Q ,反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如图所示据图分析,以下正确的是

A. T1 > T2 ,Q > 0
B. Tl < T2 ,Q > 0
C. P1 > P2 ,a+b=c+d
D. Pl< P2 ,b=c+d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知联氨(N2H4)为二元碱,25℃时向联氨水溶液中逐滴滴加盐酸溶液,混合溶液中的微粒的物质的量分数随pOH[pOH=-lgc(OH-)]变化的关系如图所示。已知联氨的两步电离分别为:N2H4+H2O![]() N2H5++OH-,N2H5++H2O
N2H5++OH-,N2H5++H2O![]() N2H62++OH-。下列叙述错误的是
N2H62++OH-。下列叙述错误的是

A. 联氨的第一步电离平衡常数Kb1=10-6
B. pOH=6时c(N2H4)与pOH=15时c(N2H62+)相同
C. 当溶液中c(N2H62+)︰c(N2H5+)=1︰1时,c(H+)=10mol/L
D. pOH由12增大到18时,对应的离子方程式为:N2H5++H+=N2H62+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
具有自主知识产权、中国制造的C919,是一款与波音737MAX同等体量的民用飞机。制造C919需要大量的合金材料,其中包括钢,钢是现代社会的物质基础,钢中除含有铁外还含有碳和少量不可避免的硅、锰、磷、硫等元素。请回答下列有关问题:
(1)基态Mn原子的价电子排布式为___________。
(2)NO3-的立体构型名称为___________,其中心原子的杂化方式为___________。
(3)C、O、Si三种元素第一电离能由大到小的顺序是___________。
(4)写出和CN-互为等电子体的一种离子的电子式___________。
(5)铵盐大多易分解,NH4F和NH4Br两种盐中较易分解的是___________(填化学式);理由是___________。
(6)氧化亚铁晶胞与NaC1的相似,NaCl的晶胞如图所示。由于晶体缺陷,某氧化亚铁晶体的实际组成为Fe0.9O,其中包含有Fe2+和Fe3+,晶胞边长为apm,该晶体的密度为ρg·cm-3,则a=___________(列出计算式即可,用NA表示阿伏加德罗常数的值)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是
A.现有CO、CO2、O3三种气体,它们都含有1molO,则三种气体的物质的量之比为3:2:1
B.相同条件下,同体积、同密度的C2H4和N2,两种气体的分子数一定相等
C.28gCO和22.4LCO2中含有的碳原子数一定相等
D.配制450mL0.1mol·L-1的NaOH溶液,用托盘天平称取NaOH固体1.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定碳酸钠纯度(只含有少量氯化钠),学生设计了如下两个实验方案。
[方案1]称取![]() 样品,置于小烧杯中,加适量水完全溶解;向小烧杯中加入足量氢氧化钡溶液,过滤,洗涤、干燥沉淀,称量沉淀的质量为19.700克,计算。
样品,置于小烧杯中,加适量水完全溶解;向小烧杯中加入足量氢氧化钡溶液,过滤,洗涤、干燥沉淀,称量沉淀的质量为19.700克,计算。
(1)写出生成沉淀的反应方程式__________________。
(2)过滤操作需要的玻璃仪器__________________。
(3)计算碳酸钠的质量分数为______________(保留两位小数)。
[方案2]用下图装置,排液法测定![]() 的体积,并根据样品质量和
的体积,并根据样品质量和![]() 的体积计算
的体积计算
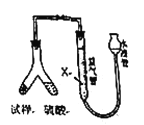
(4)为了减小测定![]() 的体积误差,量气管中加入的液体
的体积误差,量气管中加入的液体![]() 为______(填化学式)。
为______(填化学式)。
(5)通过实验,测得该试样中碳酸钠的质量分数偏高,产生这种现象的原因可能是______。
A.测定气体体积时未冷却至室温
B.气体进入量气管前未用浓硫酸干燥
C.![]() 型管中留有反应生成的气体
型管中留有反应生成的气体
D.反应结束后读数时水准管的水面高于量气管的水面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com