在NaCl、MgCl2、MgSO4三种盐配制的混合液中,Na+为0.1mol,Mg2+为0.25mol,Cl-为0.2mol,则SO42-为( )
A.0.5mol
B.0.15mol
C.0.25mol
D.0.2mol
【答案】
分析:分析:在NaCl、MgCl
2、MgSO
4三种盐配制的混合液中,NaCl、MgCl
2、MgSO
4三种强电解质完全电离.溶液中阳离子
Na
+、Mg
2+所带的正电荷总数等于阴离子Cl
-、SO
42-所带的负电荷总数.
解答:解:方法一:
在NaCl、MgCl
2、MgSO
4三种盐配制的混合液中:
NaCl=Na
++Cl
-MgCl
2═Mg
2++2Cl
-
1 1 1 1 2
0.1mol 0.1mol 0.1mol
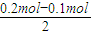
0.2mol-0.1mol
MgSO
4 =Mg
2++SO
42-
1 1
0.25mol-0.05mol 0.25mol-0.05mol
n(SO
42-)=0.2mol
故答案为D.
方法二:
在NaCl、MgCl
2、MgSO
4三种盐配制的混合液中:
阳离子Na
+、Mg
2+所带的正电荷总数等于阴离子Cl
-、SO
42-所带的负电荷总数.
n(Na
+)+2n(Mg
2+)=n(Cl
-)+2n(SO
42-)代入数据:0.1mol+2×0.25mol=0.2mol+2n(SO
42-)
n(SO
42-)=0.2mol
故答案为D.
点评:掌握溶液呈电中性的原因是阳离子所带的正电荷总数等于阴离子所带的负电荷总数,是本题解题的关键.

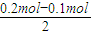 0.2mol-0.1mol
0.2mol-0.1mol 
