

| ||
. |
| 1 |
| 6 |
| 1 |
| 6 |
| ||
. |
| 1 |
| 6 |
| 1 |
| 6 |


科目:高中化学 来源: 题型:阅读理解
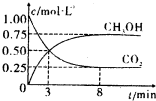 (2012?枣庄二模)碳和碳的化合物在人类生产、生活中的应用非常广泛,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
(2012?枣庄二模)碳和碳的化合物在人类生产、生活中的应用非常广泛,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.| n(H2) | n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| (1)可用改进汽油组成的办法来改善汽油的燃烧性能,例如,加入CH3OC(CH3)3来生产“无铅汽油”.CH3OC(CH3)3分子中必存在的原子间连接形式有 ③ ③ (填写编号、多选倒扣). |
| (2)天然气的燃烧产物无污染、热值高、管道输送方便,天然气将成为我国西部开发的重点之一.天然气常和石油伴生,其主要成分是 甲烷(或CH4) 甲烷(或CH4) .能说明它是正四面体而非正方形平面结构的理由是② ② (填写编号、多选倒扣). ①其一氯代物不存在同分异构体; ②其二氯代物不存在同分异构体; ③碳原子与氢原子之间以共价键结合; ④四个碳氢键是完全等价的. (3)1980年我国首次制成一辆燃氢汽车,乘员12 人,以50 km/h的速度行驶了40 km.为了有效发展民用氢能源,首先必须制得廉价的氢气.下面可供开发又较经济的制氢方法是 ③ ③ (填写编号、多选倒扣). ①电解水;②锌和稀硫酸反应;③光解海水. 其次,制得氢气后还需要解决的问题是 氢气的输送和贮存 氢气的输送和贮存 (写出其中一个). |
查看答案和解析>>
科目:高中化学 来源:09-10年邢台六中高一下学期单元测试(四)化学卷 题型:填空题
(10分)近期石油价格暴涨,有效地利用现有能源和开发新能源已受到各国的普遍重视。
(1)可用改变汽油组成的办法来改善汽油的燃烧性能,例如加入CH3OC(CH3)3生产“无铅汽油”。CH3OC(CH3)3分子中必存在的原子间的连接形式有_______(填写编号)。




(2)天然气的燃烧产物无毒、热值高、管道输送方便,将成为我国西部开发的重点之一,天然气常和石油伴生,其主要成分是__________。能说明它是正四面体而非正方形平面结构的理由是___________(填写编号)
① 其一氯代物不存在同分异构体 ② 其二氯代物不存在同分异构体
③ 碳原子与氢原子之间以共价键结合 ④ 4个碳氢键是完全等价的
(3)1980年我国首次制成一辆燃氢汽车,乘员12人,以每小时50 km的速度行使了40km。为了有效发展民用氢能源,首先必须制得廉价的氢气。下面可供开发又较经济的制氢方法是_______________(填写编号)。
①电解水 ② 锌与稀硫酸反应 ③ 光解海水
制得氢气后还需要解决的问题是_________________________(写出其中一个)。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(08长沙雅礼中学二模)(14分)I、新能源的开发利用是当今全球的一个重大研究课题,发展氢能源有着广阔的前景,有研究人员提出了“利用太阳能,以水为原料,大量生产氢气,并用作各种机械的动力燃料”这一设想。试回答下列问题:
(1)你认为这一设想能否实现?___________。(填“能”、“不能”)
(2)氢气作为燃料与现在广泛使用的化石燃料相比有什么优点?(要求答出两点)
①__________ _;②__________ 。
(3)燃料电池是一种新型的无污染、无噪音、高效率的发电设备,也是一种很有发展潜力的新能源。在燃料电池中,氢气等燃料在通常条件下就能在电极上进行电极反应(一般用多孔镍、铂等作电极材料).电池中的电解质为有机高分子高聚物,它可以交换质子.
①燃料电池的电极在常温条件下就能持续发生电极反应,写出氢氧燃料电池中的电极反应式:正极____________________________.
②氢氧燃料电池可作为载人航天器的首选电池,除它有作为燃料电池的优点外,还有一个重要原因是__。
II、环境保护是当今世界关注的热点问题。
(1)为了降低汽车尾气对空气的污染,可用纳米级的某种氧化物作催化剂,使尾气中的CO与氮氧化物(NO)反应,转化为空气中含有的两种气体(其中一种为单质),该反应的化学方程式为__________ 。
(2)超临界CO2流体是一种与水相似、能阻燃、溶解能力强的溶剂,被誉为“绿色环保溶剂”。它作为“绿色环保溶剂”的原因之一是:能代替许多有害、有毒、易燃的有机溶剂;之二是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com