
 分别将5ml下列物质分别注入15ml水中,振荡后静置,能形成如图所示的是( )
分别将5ml下列物质分别注入15ml水中,振荡后静置,能形成如图所示的是( )| A. | 全部 | B. | ①②⑤⑥ | C. | ②⑤ | D. | ①⑥ |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
 下列各组物质中,满足下如图物质一步转化关系的选项是( )
下列各组物质中,满足下如图物质一步转化关系的选项是( )| X | Y | Z | |
| A | Na | NaOH | NaHCO3 |
| B | Cu | CuSO4 | Cu(OH)2 |
| C | C | CO | CO2 |
| D | Si | SiO2 | H2SiO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
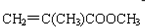 )旧法合成的反应是:
)旧法合成的反应是:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
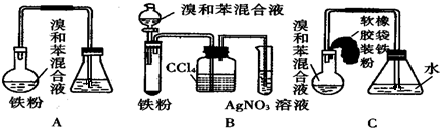
 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$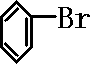 +HBr;装置A中左侧长导管的作用是导气和冷凝回流;装置A和C中的两处明显错误是锥形瓶未与大气相通、导管插入AgNO3(或水)溶液中.
+HBr;装置A中左侧长导管的作用是导气和冷凝回流;装置A和C中的两处明显错误是锥形瓶未与大气相通、导管插入AgNO3(或水)溶液中.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
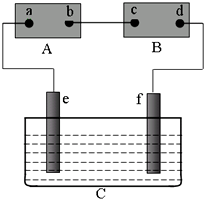
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制浓硫酸、浓硝酸的混酸时,应将浓硝酸沿玻璃棒缓慢注入浓硫酸中 | |
| B. | 用滴定管、量筒量取5.0mL液体,俯视读数时所得液体体积均大于5mL | |
| C. | 大试管、烧瓶、锥形瓶均可用于组装气体发生装置 | |
| D. | 实验室配制一定质量分数、一定物质的量浓度的溶液时均需使用容量瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com