
分析 (1)K2CO3为强碱弱酸盐,水解呈碱性,CO32-与NH4+发生互促水解;
(2)NaOH抑制水的电离,根据Kw=c(OH-)×c(H+)以及pH=-lg(c(H+))计算;
(3)减慢反应速率,可降低温度或浓度,产生的H2的总量不变,则氢离子的总物质的量不变,以此解答.
(4)难溶电解质的溶度积越小,加入氨水时越易生成沉淀.
解答 解:(1)K2CO3为强碱弱酸盐,水解呈碱性,水解离子方程式为CO32-+H2O?HCO3-+OH-,CO32-与NH4+发生互促水解,生成氨气和二氧化碳气体而降低肥效,则不能混合使用,故答案为:CO32-+H2O?HCO3-+OH-;不能;
(2)室温下pH=9的NaOH溶液中,c(OH-)=10-5mol/L,c(H+)=10-9mol/L,则由水电离产生的c(OH-)为10-9mol/L,
把0.1mol/LHCl与0.3mol/L的NaOH溶液等体积混合,NaOH过量,c(OH-)=$\frac{0.3mol/L×V-0.1mol/L×V}{2V}$=0.1mol/L,c(H+)=10-13mol/L,所得溶液的pH=13,
故答案为:10-9;13;
(3)A.加醋酸钠固体,生成醋酸为弱电解质,溶液氢离子浓度降低,反应速率减小,但生成氢气的总量不变,故A正确;
B.加NH4Cl溶液,氯化铵水解呈酸性,生成氢气的总量增大,故B错误;
C.加BaCl2溶液,氢离子总量不变,应溶液总体积增大,氢离子浓度降低,反应速率减小,故C正确;
D.加氨水,消耗酸,生成氢气总量减小,故D错误.
故答案为:AC.
(4)难溶电解质的溶度积越小,加入氨水时越易生成沉淀,则生成的沉淀为Cu(OH)2,反应的离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+,
故答案为:Cu(OH)2;Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+.
点评 本题考查Ksp的计算和盐类的水解,根据溶度积常数确定先沉淀的物质,溶度积常数越小的物质越先沉淀,铜离子和氨水反应生成氢氧化铜和铵根离子,题目难度中等.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:选择题
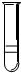 分别将5ml下列物质分别注入15ml水中,振荡后静置,能形成如图所示的是( )
分别将5ml下列物质分别注入15ml水中,振荡后静置,能形成如图所示的是( )| A. | 全部 | B. | ①②⑤⑥ | C. | ②⑤ | D. | ①⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
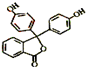 从其结构上看,酚酞属于酚或酯类衍生物,
从其结构上看,酚酞属于酚或酯类衍生物,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2与CH2=CH-CH=CH2 | B. | CH≡CH与 CH3-CH2-C≡CH | ||
| C. | CH3OH与CH3CH2OH | D. |  与 与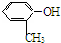 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
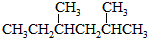 ②
②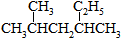 ③CH3CH2CH3
③CH3CH2CH3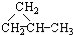 ⑥CH3CH=CHCH3.
⑥CH3CH=CHCH3.| A. | ①和② | B. | ①和③ | C. | ①和④ | D. | ⑤和⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中加人稀氨水,平衡逆向移动,c(OH-)降低 | |
| B. | 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 | |
| C. | 向水中加人少量NH4Cl固体,c(OH-)增大 | |
| D. | 将水加热,Kw增大,pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
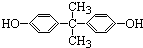 .下列有关双酚A的叙述不正确的是( )
.下列有关双酚A的叙述不正确的是( )| A. | 不能和NaOH溶液反应 | B. | 能和FeCl3溶液反应显紫色 | ||
| C. | 能和浓溴水反应 | D. | 苯环上一溴代物有四种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com