

分析 (1)分离固体和液体用过滤,将碘水转化为含碘的有机溶液,需用对卤素单质溶解能力强的有机溶剂把碘从碘水中提取出来,对应进行的实验操作是萃取;
(2)步骤④对应反应是氯气氧化碘离子为碘单质的反应;
(3)利用碘易溶于有机溶剂的性质来进行提取,须注意:选择的能提取碘的试剂除了对I2有强的溶解能力处,还必须难溶于水,否则不能进行分液分离;
(4)分液漏斗和普通漏斗的作用分别为萃取和过滤;
(5)烧杯加热应垫石棉网,温度计水银球应位于蒸馏烧瓶支管口处.
解答 解:(1)将悬浊液分离为残渣和含碘离子溶液应选择过滤的方法.将碘水转化为含碘的有机溶液,需用对卤素单质溶解能力强的有机溶剂把碘从碘水中提取出来,对应进行的实验操作是萃取,故答案为:过滤;萃取分液;
(2)步骤④对应反应是氯气氧化碘离子为碘单质的反应,反应的离子方程式为:Cl2+2I-═I2+2Cl-,
故答案为:Cl2+2I-═I2+2Cl-;
(3)利用碘易溶于有机溶剂的性质来进行提取,须注意:选择的能提取碘的试剂除了对I2有强的溶解能力处,还必须难溶于水,否则不能进行分液分离,符合条件的是四氯化碳或苯,酒精、醋酸溶于水不能分层,
故答案为:CD;
(4)分液漏斗用来萃取,普通漏斗用来过滤,恰好少了这两种玻璃仪器,
故答案为:分液漏斗、普通漏斗;
(5)烧杯加热应垫石棉网,温度计水银球应位于蒸馏烧瓶支管口处,
故答案为:缺石棉网、温度计插到液体中.
点评 本题考查制备实验方案的设计,题目难度中等,注意基本实验操作的要点和注意事项,物质性质和提取原理是关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 +Br2$\stackrel{FeBr_{3}}{→}$
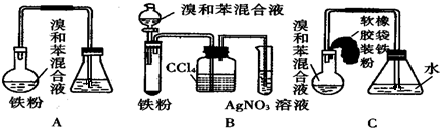
+Br2$\stackrel{FeBr_{3}}{→}$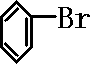 +HBr;装置A中左侧长导管的作用是导气和冷凝回流;装置A和C中的两处明显错误是锥形瓶未与大气相通、导管插入AgNO3(或水)溶液中.
+HBr;装置A中左侧长导管的作用是导气和冷凝回流;装置A和C中的两处明显错误是锥形瓶未与大气相通、导管插入AgNO3(或水)溶液中.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)常温下将0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略溶液体积的变化),
(1)常温下将0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略溶液体积的变化),查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(CH3COOH)+c(H+ )<c(OH-)+c(CH3COO-) | B. | c(H+ )+c(CH3COOH)=c(OH-)+c(CH3COO-) | ||
| C. | c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | D. | c(Na+)=c(CH3COOH)+c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=b+n-m | B. | 离子半径Y m-<X n+ | ||
| C. | 原子序数Y>X | D. | 原子半径X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25°C时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 | |
| B. | 25°C时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大 | |
| C. | 25°C时,Mg(OH)2固体在20mL0.01 mol•L-1氨水中的Ksp比在20mL0.01mol•L-1NH4Cl溶液中的Ksp小 | |
| D. | 25°C时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径按X、Y、Z、R、W的顺序一次增大 | |
| B. | WY2能与强碱溶液反应,但不能与任何酸反应 | |
| C. | Z与Y形成的化合物是碱性氧化物 | |
| D. | W的最高价氧化物对应的水化物难溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com