
【题目】25℃时,下列四种溶液中,由水电离生成的氢离子浓度之比
①pH=0的盐酸 ②0.1 mol/L的盐酸
③0.01 mol/L的NaOH溶液 ④pH=14的NaOH溶液
A. 1∶10∶100∶1 B. 1∶10-1∶10-12∶10-14
C. 14∶13∶12∶14 D. 14∶13∶2∶1
【答案】A
【解析】
电离平衡为H2O![]() H++OH-,在水中加入酸或者碱溶液,溶液中氢离子或者氢氧根离子浓度增大,抑制水的电离;酸溶液中氢氧根离子是水电离的,碱溶液中氢离子是水电离,结合Kw=c(H+)c(OH-)计算。
H++OH-,在水中加入酸或者碱溶液,溶液中氢离子或者氢氧根离子浓度增大,抑制水的电离;酸溶液中氢氧根离子是水电离的,碱溶液中氢离子是水电离,结合Kw=c(H+)c(OH-)计算。
酸溶液中,氢氧根离子是水电离,碱溶液中氢离子是水电离的,水电离的氢离子浓度等于水电离的氢氧根离子都浓度。
①1mol·L-1的盐酸,溶液中氢离子浓度为1mol·L-1,水电离的氢离子为10-14/1mol·L-1=1×10-14mol·L-1;
②0.1mol·L-1盐酸,溶液中氢离子浓度为0.1mol·L-1,水电离的氢离子为10-14/0.1mol·L-1=1×10-13mol·L-1;
③0.01mol·L-1的NaOH 溶液,溶液中氢离子浓度为10-14/0.01mol·L-1=1×10-12mol·L-1;
④1mol·L-1的NaOH 溶液,溶液中氢离子浓度为10-14/1mol·L-1=1×10-14mol·L-1;
所以由水电离产生的c(H+)之比①:②:③:④=1×10-14mol·L-1:1×10-13mol·L-1:1×10-12mol·L-1:1×10-14mol·L-1=1:10:100:1,
故选:A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示。

(1)X的转化率是______;
(2)由图中所给数据进行分析,该反应的化学方程式为______;
(3)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=__________;
(4)当反应进行到第____min,该反应是达到平衡。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量且足量的两份锌a、b,分别加入等量的稀H2SO4,同时向a中加入少量的CuSO4溶液,下列各图表示产生H2的体积(V)与时间(t)的关系,其中正确的是 ( )
A. 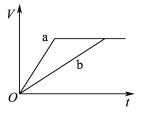 B.
B. 
C. 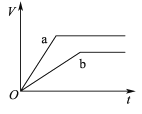 D.
D. 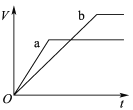
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,将10 mol CO和一定量的H2S混合加热并达到下列平衡:CO(g)+H2S(g) ![]() COS(g)+H2(g) K=1,平衡后CO物质的量为8 mol。下列说法正确的是
COS(g)+H2(g) K=1,平衡后CO物质的量为8 mol。下列说法正确的是
A. CO.H2S的转化率之比为1:1
B. 达平衡后H2S的体积分数为4%
C. 升高温度,COS浓度减小,表明该反应是吸热反应
D. 恒温下向平衡体系中再加入CO.H2S.COS.H2各1 mol,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是七个基本____________之一,用来表示____________________的集合,符号是___________,单位符号是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钪(Sc)及其化合物在电子、宇航、超导等方面有着广泛的应用。某工厂的钛白水解工业废酸中,Sc3+浓度为18mg/L,还含有大量的TiO2+、Fe3+、H+、SO42-等。下图为从该工业废酸中提取Sc2O3的一种流程。

回答下列问题:
(1)在钛白水解工业废酸中,加入双氧水是为了使TiO2+转化为难萃取的[Ti(O2)(OH(H2O)4]+。[Ti(O2)(OH(H2O)4]+中Ti的化合价为+4,其中非极性键的数目为_______。
(2)钪的萃取率(E%)与O/A值[萃取剂体积(O)和废酸液体积(A)之比]的关系如左下图,应选择的最佳O/A值为_______;温度对钪、钛的萃取率影响情况见右下表,合适的萃取温度为10-15℃,其理由是_____________________。

(3)洗涤“油相“可除去大量的钛离子。洗染水是用浓硫酸、双氧水和水按一定比例混合而成。混合过程的实验操作为________________。
(4)25℃时,用氨水调节滤液的pH,当pH=3.5时,滤渣II的主要成分是_______;当pH=6时,滤液中Sc3+的浓度为________。(Ksp[Fe(OH)3]=2.6×10-39,Ksp[Sc(OH)3]=9.0×10-31)
(5)写出用草酸(H2C2O4)“沉钪”得到Sc2(C2O4)3的离子方程式_____________。
(6)若从1m3该工厂的钛白水解度酸中提取得到24.4gSc2O3,则钪的提取率为______(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)某化学实验小组为确定过氧化氢分解的最佳催化条件,用如图装置进行实验,反应物用量和反应停止的时间数据如下表:

请回答下列问题:
(1)盛装双氧水的化学仪器名称是__________。
(2)如何检验该套装置的气密性__________________________________________________。
(3)相同浓度的过氧化氢,其分解速率随着二氧化锰用量的增加而__________。
(4)从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入______g的二氧化锰为较佳选择。
(5)某同学分析上述数据后认为:“当用相同质量的二氧化锰时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确_________________,理由是_________________________________________________。(提示:H2O2的密度可认为近似相等)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com