
【题目】锌–空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH–+2H2O![]() 2Zn(OH)
2Zn(OH) ![]() 。下列说法正确的是 ( )
。下列说法正确的是 ( )
A. 充电时,电解质溶液中K+向阳极移动
B. 放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)
C. 充电时,阳极反应为:Zn(OH) ![]() +2e–=== Zn+4OH–
+2e–=== Zn+4OH–
D. 放电时,电解质溶液中K+向正极移动
科目:高中化学 来源: 题型:
【题目】实验室模拟工业利用氟磷灰石[Ca5(PO4)3F]生产磷铵[(NH4)3PO4]和白磷。其工艺流程如下图所示:

(1)氟磷灰石中磷元素的化合价为________,气体A 的电子式为________________;固体B 的化学式为____________________________。
(2)沸腾槽不能用陶瓷材质的原因是_______________________(用化学方程式表示)。
(3)工业上还可以用氟磷灰石与焦炭、石英砂混合,在电炉中加热到1500 ℃生成白磷,同时逸出SiF4和CO,该反应的化学方程式为____________________________。
(4)在装置I中通入过量氨气的目的是___________________________________________。
(5)磷铵与草木灰不能混合使用的原因是______________________________________。
(6) (NH4)3PO4溶液中含磷离子浓度的大小顺序是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg—H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )
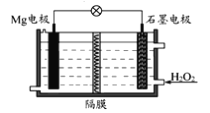
A. Mg电极是该电池的正极
B. H2O2在石墨电极上发生氧化反应
C. 石墨电极附近溶液的pH增大
D. 溶液中Cl-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
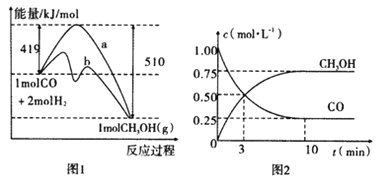
【题目】工业上用CO生产燃料甲醇。一定温度和容积条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
请回答下列问题:
(1)在“图1”中,曲线_________(填“a”或“b”)表示使用了催化剂;没有使用催化剂时,在该温度和压强条件下反应CO(g)+2H2(g)![]() CH3OH(g)的△H=_____________。
CH3OH(g)的△H=_____________。
(2)下列说法正确的是__________。
A.起始充入的CO的物质的量为1mol
B.增加CO的浓度,H2的转化率会增大
C.容器中压强恒定时,反应达到平衡状态
(3)从反应开始到建立平衡,v(CO)=____________;达到平衡时,c(H2)=_________,该温度下CO(g)+2H2(g) ![]() CH3OH(g)的化学平衡常数为______________。达到平衡后若保持其它条件不变,将容器体积压缩为0.5L,则平衡___________移动 (填“正向”、“逆向”或“不”)(4)已知CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g);ΔH=-193kJ/mol。又知H2O(l)= H2O(g)ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式___________________________________________________。
CH3OH(g)的化学平衡常数为______________。达到平衡后若保持其它条件不变,将容器体积压缩为0.5L,则平衡___________移动 (填“正向”、“逆向”或“不”)(4)已知CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g);ΔH=-193kJ/mol。又知H2O(l)= H2O(g)ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式___________________________________________________。
(5)已知白磷和PCl3的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):P—P:198,Cl—Cl :243,P—Cl:331。
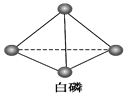
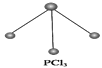
则反应P4(白磷,s)+6Cl2(g)![]() 4PCl3(s)的反应热ΔH=____________________。
4PCl3(s)的反应热ΔH=____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某恒定温度下,在一个2L的密闭容器中充入A气体、B气体,测得其浓度为2mol/L和1mol·L-1;且发生如下反应:3A(g)+2B(g)![]() 4C(?)+2D(?)已知“?”代表C、D状态未确定;反应一段时间后达到平衡,测得生成1.6molC,且反应前后压强比为5:4,则下列说法中正确的是( )
4C(?)+2D(?)已知“?”代表C、D状态未确定;反应一段时间后达到平衡,测得生成1.6molC,且反应前后压强比为5:4,则下列说法中正确的是( )
①该反应的化学平衡表达式为:K= 
②此时B的转化率为35%
③增大该体系压强,平衡向右移动,但化学平衡常数不变.
④增加C的量,A、B转化率不变
A.①② B.②③ C.①④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 氢氧燃料电池放电时化学能全部转化为电能
B. 反应4Fe(s)+3O2(g)![]() 2Fe2O3(s)常温下可自发进行,该反应为吸热反应
2Fe2O3(s)常温下可自发进行,该反应为吸热反应
C. 3 mol H2与1 mol N2混合反应生成NH3,转移电子的数目小于6×6.02×1023
D. 在酶催化淀粉水解反应中,温度越高淀粉水解速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沉淀转化广泛应用于工业生产和科学实验。为了探究AgCl、Ag2S(黑色)的溶解性及转化等相关性质,做以下实验:
步 骤 | 现 象 |
Ⅰ.将NaCl溶液滴入AgNO3溶液中至恰好完全反应。 | 产生白色沉淀。 |
Ⅱ.过滤出Ⅰ中的白色沉淀置于试管中,在试管中加入过量Na2S溶液并充分振荡。 | 白色沉淀变为黑色。 |
Ⅲ.过滤出Ⅱ中的黑色沉淀置于试管中,在试管中加入过量的NaCl溶液并充分振荡后静置。 | 沉淀由黑色最后完全变为乳白色。 |
回答下列问题:
(1)Ⅰ中的白色沉淀是__________。
(2)写出Ⅱ中沉淀变黑的离子方程式__________ ,沉淀转化的主要原因是______________。
(3)滤出步骤Ⅲ中的乳白色沉淀,加入过量的浓HNO3使之充分反应,有红棕色气体生成,尚有部分沉淀未溶解,过滤得到滤液X和白色沉淀Y。
ⅰ.向X中滴加Ba(NO3)2溶液,产生白色沉淀;
ⅱ.将Y与足量的KI溶液充分混合,白色沉淀最终转化为黄色沉淀。
① 由ⅰ判断,滤液X中被检出的离子是_______。
② 由ⅰ、ⅱ可确认步骤Ⅲ中乳白色沉淀含有__________和__________。
(4)为了证明实验步骤Ⅲ中的黑色沉淀只有在NaCl存在下,才能和氧气反应转化为乳白色沉淀,设计了如下对照实验并将实验结果记录在右侧的表格中。
装置 | 实验结果 |
B | 一段时间后,出现乳白色沉淀 |
C | 一段时间后,无明显变化 |
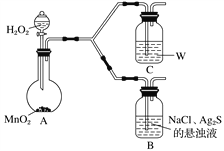
①A中,盛有MnO2的玻璃仪器名称是_________________。
②C中盛放的是物质W的悬浊液,W是________(填化学式)。
③请完成B中发生反应的反应式并配平:_____
Ag2S+ + + H2O![]() AgCl+ + NaOH
AgCl+ + NaOH
________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列用来表示物质变化的化学用语中,正确的是( )
A. 钢铁发生电化学腐蚀的正极反应式:Fe﹣2e﹣=Fe2+
B. HS﹣的水解方程式:HS﹣+H2O![]() S2﹣+H3O+
S2﹣+H3O+
C. CO32﹣的水解方程式:CO32﹣+H2O![]() HCO3﹣+OH﹣
HCO3﹣+OH﹣
D. AlCl3溶液与Na2CO3溶液混合:2Al3++3CO32﹣=Al2(CO3)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaHSO4在水中的电离方程式为NaHSO4=Na++H++SO42-。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2,对于该溶液,下列叙述中正确的是
A. 水电离出来的c(H+)=1×10-10mo1·L-1
B. 此时水的离子积KW=1×10-4
C. c(H+)=2[c(OH-)+c(SO42-)]
D. 该温度下加入等体积pH=12的NaOH溶液可使反应后的溶液恰好呈中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com