
【题目】氮的化合物在生产生活中广泛存在.
(1)处理生活污水中的NH4+ , 过程如图1: 
①根据较新的研究表明,将只含NO2﹣的污水与含NH4+的污水按比例混合,直接转化为无毒气体,该气体为 .
②空气将NH4+转变为NO3﹣或NO2﹣ , 溶液pH(填“增大”、“减小”或“不变”).
③完全处理含1mol NH4+污水,则n(O2)与n(CH3OH)关系式为[用n(O2)与n(CH3OH)表示].
(2)用焦炭还原NO2的反应为:2NO2(g)+2C(s )N2(g)+2CO2(g),在恒温条件下,1mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图2所示: 
①A、B两点的浓度平衡常数关系:Kc(A)Kc(B) (填“>”、“<”或“﹦”).
②A、B、C三点中NO2的转化率最高的是(填“A”或“B”或“C”)点.
③计算C点时该反应的压强平衡常数Kp(C)=(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
【答案】
(1)N2;减小;4n(O2)=3+6n(CH3OH)
(2)=;A;2MPa
【解析】解:(1)①NO2﹣的污水与含NH4+的污水按比例混合,转化的无毒气体是氮气;所以答案是:N2;②空气将NH4+转变为NO3﹣或NO2﹣的反应为:NH4++2O2=NO3﹣+2H++H2O,酸性增强,PH减小;所以答案是:减小; ③全处理含1mol NH4+污水,整个过程铵根离子、甲醇是还原剂,只有氧气是氧化剂,氧气得到的电子为4n(O2)mol,1molNH4+失电子为3mol,甲醇失电子为6n(CH3OH),根据得失电子守恒则:4n(O2)=3+6n(CH3OH);
所以答案是:4 n(O2)=3+6n(CH3OH);(2)①A、B两点温度相等,所以化学平衡常数相等;所以答案是:=; ②由方程式可知反应气体体积减小,增大压强,平衡逆向移动,NO2的转化率降低,A、B、CA点压强最小,所以转化率最高;所以答案是:A; ③设生成二氧化碳2x mol,列三段式:
2NO2(g)+ | 2C(s ) | N2(g)+ | 2CO2(g) | ||
起始物质的量: | 1 | 0 | 0 | ||
转化物质的量: | 2x | x | 2x | ||
平衡物质的量: | 1-2x | x | 2x |
C点时NO2和CO2浓度相等,则1﹣2x=2x,解得:x=0.25,因,C点时NO2和CO2浓度相等,则NO2和CO2的分压也相等,即Kp(NO2)=Kp(CO2),Kp(C)= ![]() =Kp(N2)=10MPa×
=Kp(N2)=10MPa× ![]() =2MPa;所以答案是:2 MPa.
=2MPa;所以答案是:2 MPa.
【考点精析】解答此题的关键在于理解化学平衡的计算的相关知识,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
【题目】某同学用实验室制法制备NH3并用制得的氨气做一些性质实验。设计如下的装置(图中铁夹等夹持装置已略去),进行有关实验。
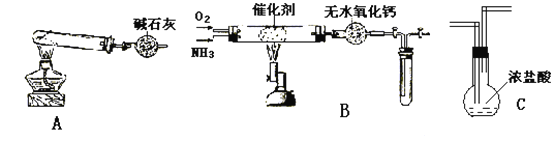
(1)装置A制取纯净、干燥的氨气,大试管内发生的化学方程式:_______________________,A中装碱石灰的仪器名叫________________ ,碱石灰的作用____________________,收集氨气应用____________________法,检验氨气是否集满的方法及现象是_______________________。
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:
①氨催化氧化的化学方程式:_________________________________________________。
② B装置右侧试管内气体变为红棕色,该反应的化学方程式:____________________。
(3)若将氨气通入C中现象为_____________,反应的方程式:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、C均为银白色金属单质,B为黑色磁性金属氧化物,它们之间的转化关系如下图(部分反应物和生成物省略),请回答下列问题:
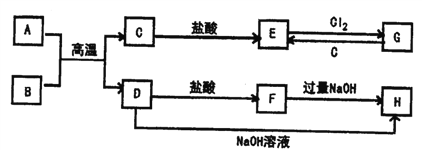
(1)写出B的化学式__________________、H的化学式______________
(2)写出A与B反应的化学方程式_____________________
写出D+NaOH→H的化学方程式_____________________
写出G+C→E的离子方程式______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知:Mg(s)+2I H2O (g)=Mg(OH )2(s)+H2(g)△H1=﹣441kJmol﹣1
H2O(g)= ![]() H2(g)+O2(g)△H2=242kJmol﹣1
H2(g)+O2(g)△H2=242kJmol﹣1
Mg(s)+ ![]() O2(g)=MgO(s)△H3=﹣602kJmol﹣1
O2(g)=MgO(s)△H3=﹣602kJmol﹣1
①Mg(OH )2分解的热化学方程式为: .
②Mg(OH )2可以作为阻燃剂的原因(写一条即可) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向一定体积0.1molL﹣1的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液pOH[pOH=﹣lgc(OH﹣)]与pH的变化关系如图所示,则( ) 
A.N点处pH>pOH,则N点处所示溶液呈酸性
B.该温度下水的离子积Kw=1×10﹣2a
C.Q点所示溶液呈中性,则M,N,Q三点中只有Q点溶液中水的电离出的c(H+)与水的电离c(OH﹣)相等
D.M点所示溶液的导电能力强于Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于“摩尔”的说法和理解正确的是
A. 摩尔是国际科学界建议采用的一种物理量
B. 摩尔可以把物质的宏观数量与微观粒子的数量联系起来
C. 国际上规定,0.012kg碳原子所含有的碳原子数目为1摩
D. 摩尔是物质的量的单位,简称摩,符号为mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)用绿矾晶体配制硫酸亚铁溶液时需加入少量铁粉,其目的是____________________,若绿矾失去了部分结晶水,会导致配制的溶液浓度__________(偏大、偏小、无影响)。
(2)设计实验检验绿矾晶体是否变质,写出实验方案:_______________________;
(3)若要检验硫酸铁溶液中是否含有Fe2+, 最好选用________________。
A.KSCN溶液、氯水 B. 酸性KMnO4溶液 C. NaOH溶液 D. H2O2溶液
(4)为测定绿矾中结晶水含量,将石英玻璃管(带端开关K1和K2)(装置A)称重,记为m 1 g。将样品装入石英玻璃管中,再次将装置A称重,记为m 2 g。按下图连接好装置进行实验。
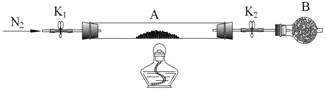
①仪器B的名称是____________________。
②用N2排净装置中的空气,加热装置A,使其彻底失去结晶水直至A恒重,记为m3 g。
③根据实验记录,计算绿矾化学式中结晶水数目x=________________(列式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com