
27.(14分)氮是一种非常重要的元素,它的单质和化合物应用广泛,在科学技术和生产中有重要的应用。试回答下列问题:
(1)N2和H2为原料合成氨气的反应为:N2(g)+3H2(g) 2NH3(g) △H<0,下列措施可以提高H2的转化率是(填选项序号) 。
2NH3(g) △H<0,下列措施可以提高H2的转化率是(填选项序号) 。
a.选择适当的催化剂 b.增大压强
c.及时分离生成的NH3 d.升高温度
(2)在恒温条件下,将N2与H2按一定比例混合的气体充入一个2L固定容积的密闭容器中,10分钟后反应达平衡时,n(N2)=1.0mol,n(H2)=1.0mol,n(NH3)=0.4mol,则反应速率v(N2)= mol/(L·min)。
(3)在容积恒定的密闭容器中进行反应2NO(g)+O2(g) 2NO2(g) △H>0
2NO2(g) △H>0
该反应的反应速率(v)随时间(t)变化的关系如下图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号) 。

a.在t1-t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施一定是升高温度
c.在t3-t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t0-t5时,容器内NO2的体积分数在t3-t4时值的最大
(4)氨和联氨(N2H4)是氮的两种常见化合物,最常见的制备联氨的方法是以丙酮为催化剂,用次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式: 。
(5)已知:N2(g)+O2(g) = 2NO(g) △H=+180.5kJ/mol
N2(g)+3H2(g)  2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g)+O2(g) = 2H2O(g) △H=-483.6kJ/mol
若有17 g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为 。
(6)直接供氨式碱性燃料电池的电池反应式是4NH3 + 3O2 = 2N2 + 6H2O,电解质溶液一般使用KOH溶液,则负极电极反应式是 .从理论上分析,该电池工作过程中 (填“需要”或“不需要”)补充碱(KOH).
(1) bc
(2)0.01
(3)a d
(4)NaClO+2NH3=N2H4+NaCl+H2O
(5)226.25 kJ
(6)2NH3+6OH——6e—=N2+6H2O;不需要
【解析】
试题分析:(1)选择催化剂只能加快反应速率,但不影响平衡的移动,H2的转化率不变;增大压强,平衡向体积缩小的方向移动,即平衡正向移动,H2的转化率增大;分离出NH3,生成物浓度降低,平衡正移,H2的转化率增大;升高温度,平衡向吸热的方向移动,即逆向移动,H2的转化率降低。
(2) N2(g)+3H2(g)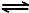 2NH3(g)
2NH3(g)
始 1.2 1.6 0
转 0.2 0.6 0.4
平 1 1 0.4
V(N2)=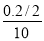 mol/(L·S)=0.01 mol/(L·S)
mol/(L·S)=0.01 mol/(L·S)
(3)2NO(g)+O2(g)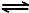 2NO2(g) △H>0,反应为气体体积减小的放热反应,a.该反应是气体物质的量减小的反应,恒温恒容时,压强不变,说明达到平衡;b.正反应是放热反应,升高温度,平衡逆向移动,在t2时,正逆速率都增大,且正反应速率增大更多,平衡正移,该反应是气体体积减小的反应,增大压强平衡正移,转化率增大,不是升温变化;c.恒容条件下,反应混合气体的总质量不变,密度始终不变,所以不能说明反应达到平衡状态;d.由图可知,在t2时,改变条件平衡正移,t3时达到平衡,t4时瞬间正反应速率不变,逆反应速率减小,平衡正移,应是NO2降低的浓度,故容器内NO2的体积分数在t3时值最大。
2NO2(g) △H>0,反应为气体体积减小的放热反应,a.该反应是气体物质的量减小的反应,恒温恒容时,压强不变,说明达到平衡;b.正反应是放热反应,升高温度,平衡逆向移动,在t2时,正逆速率都增大,且正反应速率增大更多,平衡正移,该反应是气体体积减小的反应,增大压强平衡正移,转化率增大,不是升温变化;c.恒容条件下,反应混合气体的总质量不变,密度始终不变,所以不能说明反应达到平衡状态;d.由图可知,在t2时,改变条件平衡正移,t3时达到平衡,t4时瞬间正反应速率不变,逆反应速率减小,平衡正移,应是NO2降低的浓度,故容器内NO2的体积分数在t3时值最大。
(4)制备肼的方法,是以次氯酸钠氧化氨气,反应中还原剂与氧化剂的物质的量之比为2:1,制得肼的稀溶液,反应为NaClO+2NH3=N2H4+NaCl+H2O
(5)根据盖斯定律,△H=①×2-②×2+③×3=905.2kJ/mol,那么17g即1mol氨气催化氧化所放出的热量为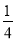 ×905.2kJ/mol=226.25 kJ
×905.2kJ/mol=226.25 kJ
(6)燃料电池中,负极是燃料发生失电子的氧化反应,所以氨气作为燃料电池燃气时,负极上史氨气失电子的过程,即2NH3+6OH——6e—=N2+6H2O;正极反应为O2+2H2O+4e-=4OH-,根据电子守恒分析,正负极反应和生成的OH-相同,理论上分析不需要补充KOH。
考点:化学平衡及影响因素、热化学方程式、化学电源、


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源:2014-2015学年北京市昌平区高二上学期期末考试化学试卷(解析版) 题型:选择题
下列关于甘氨酸(H2N-CH2-COOH)性质的说法中正确的是
A.只有酸性,没有碱性 B.只有碱性,没有酸性
C.既有酸性,又有碱性 D.既没有酸性,又没有碱性
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省绵阳市高一上学期期末化学试卷(解析版) 题型:填空题
镁与稀硝酸的反应为:Mg+ HNO3(稀)—— Mg(NO3)2+ NH4NO3+ H2O
(1)配平上述化学方程式并用“双线桥法”表示该反应中电子转移的方向和数目。
(2)该反应中,还原产物是_________,HNO3表现了________(选填“还原性”、“氧化性”、“酸性”、“碱性”)。
(3)若反应过程中转移的电子数为6.02×1023,则被还原的硝酸物质的量为________。
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省绵阳市高一上学期期末化学试卷(解析版) 题型:选择题
用铜锌合金制成的黄铜制品貌似黄金,下列方法不易区分其真伪的是
A.外观观察 B.放入盐酸中 C.测定密度 D.高温灼烧
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市西城区高三上学期期末考试化学试卷(解析版) 题型:选择题
19.(10分)自然界中氮元素有多种存在形式。
(1)合成氨反应的化学方程式是 。
(2)NH3在一定条件下可被氧化。
已知:ⅰ.4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH=﹣1269 kJ/mol
ⅱ.
① 断开1 mol H-O 键与断开 1 mol H-N 键所需能量相差约______kJ;
② H-O 键比H-N键(填“强”或“弱”)______。
(3)下图是某压强下, N2与H2按体积比1: 3投料时,反应混合物中氨的体积分数随温度的变化曲线。其中一条是经过一定时间反应后的曲线,另一条是平衡时的曲线。

① 图中b点,U(正)______ U(逆)。(填“>”、“=”或“<”)
② 图中a点,容器内气体n(N2):n(NH3)= 。
(4)水中的氨在微生物作用下可被氧化为亚硝酸,其化学方程式是 。
(5)电解法能将碱性溶液中的NO2转化为N2而除去,其电极反应式是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市西城区高三上学期期末考试化学试卷(解析版) 题型:选择题
2.下列有关物质水解的说法正确的是
A.纤维素不能水解成葡萄糖 B.油脂水解产物之一是甘油
C.蛋白质水解的最终产物是多肽 D.蔗糖水解产物仅有葡萄糖
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高二上学期第二次统练化学试卷(解析版) 题型:选择题
9.下列事实不能用勒夏特列原理解释的是
A.热的纯碱去污效果更好
B.在H2、I2和HI组成的平衡体系加压后,混合气体颜色变深
C.实验室可用排饱和食盐水的方法收集氯气
D.高压下有利于提高合成氨的产率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com