
9.下列事实不能用勒夏特列原理解释的是
A.热的纯碱去污效果更好
B.在H2、I2和HI组成的平衡体系加压后,混合气体颜色变深
C.实验室可用排饱和食盐水的方法收集氯气
D.高压下有利于提高合成氨的产率
科目:高中化学 来源:2014-2015学年江西省高三上学期第五次月考理综化学试卷(解析版) 题型:填空题
27.(14分)氮是一种非常重要的元素,它的单质和化合物应用广泛,在科学技术和生产中有重要的应用。试回答下列问题:
(1)N2和H2为原料合成氨气的反应为:N2(g)+3H2(g) 2NH3(g) △H<0,下列措施可以提高H2的转化率是(填选项序号) 。
2NH3(g) △H<0,下列措施可以提高H2的转化率是(填选项序号) 。
a.选择适当的催化剂 b.增大压强
c.及时分离生成的NH3 d.升高温度
(2)在恒温条件下,将N2与H2按一定比例混合的气体充入一个2L固定容积的密闭容器中,10分钟后反应达平衡时,n(N2)=1.0mol,n(H2)=1.0mol,n(NH3)=0.4mol,则反应速率v(N2)= mol/(L·min)。
(3)在容积恒定的密闭容器中进行反应2NO(g)+O2(g) 2NO2(g) △H>0
2NO2(g) △H>0
该反应的反应速率(v)随时间(t)变化的关系如下图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号) 。

a.在t1-t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施一定是升高温度
c.在t3-t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t0-t5时,容器内NO2的体积分数在t3-t4时值的最大
(4)氨和联氨(N2H4)是氮的两种常见化合物,最常见的制备联氨的方法是以丙酮为催化剂,用次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式: 。
(5)已知:N2(g)+O2(g) = 2NO(g) △H=+180.5kJ/mol
N2(g)+3H2(g)  2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g)+O2(g) = 2H2O(g) △H=-483.6kJ/mol
若有17 g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为 。
(6)直接供氨式碱性燃料电池的电池反应式是4NH3 + 3O2 = 2N2 + 6H2O,电解质溶液一般使用KOH溶液,则负极电极反应式是 .从理论上分析,该电池工作过程中 (填“需要”或“不需要”)补充碱(KOH).
查看答案和解析>>
科目:高中化学 来源:2015-2015湖南省高二12月学科联赛化学试卷(解析版) 题型:选择题
11.已知温度T时水的离子积常数为 。该温度下,将浓度为amol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
。该温度下,将浓度为amol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
A.a=b
B.混合溶液的pH=7
C.混合溶液中,
D.混合溶液中,
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高二上学期第二次统练化学试卷(解析版) 题型:选择题
21.化学中通常用图像直观地描述化学反应进程或结果。下列图像及描述正确的是
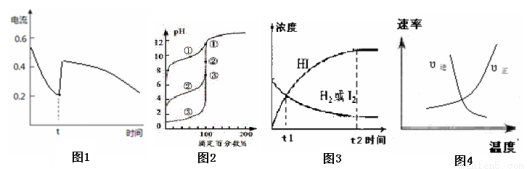
A.图1表示Zn-Cu原电池反应过程中的电流强度的变化,t时可能加入了双氧水
B.图2表示用0.1000mol·L-1NaOH溶液滴定浓度相同的三种一元酸,曲线①的酸性最强
C.图3表示可逆反应:H2(g)+I2(g) 2HI(g)在一段时间内,各组分浓度的变化图,t1时刻速率关系为:υ正=υ逆
2HI(g)在一段时间内,各组分浓度的变化图,t1时刻速率关系为:υ正=υ逆
D.图4表示可逆反应:N2(g)+O2(g) 2NO(g)ΔH <0 ,正、逆反应速率随温度变化的曲线图
2NO(g)ΔH <0 ,正、逆反应速率随温度变化的曲线图
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高二上学期第二次统练化学试卷(解析版) 题型:选择题
14.有媒体报道一种新型污水处理装置问世,该装置可利用一种微生物将有机废水的化学能直接转化为电能,该装置的构造如图所示。下列说法中正确的是
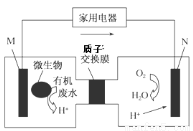
A.装置外电路中箭头的方向代表电流的方向
B.该装置为原电池装置,其中N为负极
C.若有机废水中含有葡萄糖,则M电极发生的电极反应式为C6H12O6+6H2O-24e-===6CO2+24H+
D.该处理工艺会导致有机废水酸性增强,仍旧不能直接排放
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高二上学期第二次统练化学试卷(解析版) 题型:选择题
4.常温下在水中加入下列物质,不会破坏水的电离平衡的是
A.通入HCl气体 B.加入氨水 C.加入乙醇 D.加入金属钠
查看答案和解析>>
科目:高中化学 来源:2014-2015云南省景洪市高一上学期期中化学试卷(解析版) 题型:填空题
22、写出下列物质反应的离子方程式为
(1)HCl与Na2CO3:____________ ____________;
(2)HCl与AgNO3:____________ ______________。
查看答案和解析>>
科目:高中化学 来源:2014-2015云南省景洪市高一上学期期中化学试卷(解析版) 题型:选择题
5、下图所示是分离混合物时常用的仪器,从左至右,可以进行的混合物分离操作分别是

A、蒸馏、过滤、萃取、蒸发 B、蒸馏、蒸发、萃取、过滤
C、萃取、过滤、蒸馏、蒸发 D、过滤、蒸发、萃取、蒸馏
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省文登市高二上学期期末考试化学试卷(解析版) 题型:选择题
麦考酚酸是一种有效的免疫抑制剂,能有效地防止肾移植排斥,其结构简式如下图所示: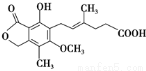 ,有关麦考酚酸说法错误的是
,有关麦考酚酸说法错误的是
A.能与FeCl3溶液发生显色反应
B.在一定条件下可发生加成、取代、消去反应
C.1 mol麦考酚酸最多能与4 mol H2反应
D.1 mol麦考酚酸最多能与3 mol NaOH反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com