
【题目】下列有关实验的图示及分析均正确的是
选项 | 实验目的 | 实验图示 | 实验分析 |
A | 催化裂解正戊烷并收集产物 |
| 正戊烷裂解为分子较小的烷烃和烯烃 |
B | 酸碱中和滴定 |
| 摇动锥形瓶,使溶液向一个方向做圆周运动,勿使瓶口接触滴定管,溶液也不得溅出 |
C | 制取并收集乙炔 |
| 用饱和食盐水代替纯水,可达到降低反应速率的目的 |
D | 实验室制硝基苯 |
| 反应完全后,可用仪器a、b蒸馏得到产品 |
A.AB.BC.CD.D
【答案】B
【解析】
A.正戊烷裂解为分子较小的烷烃和烯烃,常温下均为气体,不能冷凝收集,且催化裂化中使用碎瓷片作催化剂且有聚热功能,若改用没有聚热功能的氧化铝固体,实验效果不理想,故A错误;
B.滴定时左手控制活塞,右手摇瓶,使溶液向一个方向做圆周运动,勿使瓶口接触到滴定管,溶液也不得溅出,操作合理,故B正确;
C.用饱和食盐水代替纯水能减缓反应速率,从而可以得到较平缓的乙炔气流,但乙炔的摩尔质量与空气的摩尔质量相近,排空气法收集乙炔不纯,利用乙炔难溶于水的性质,应使用排水法收集,故C错误;
D.反应完全后,硝基苯与酸分层,应选分液漏斗分离,粗产品再蒸馏得到硝基苯,图中仪器b为圆底烧瓶,蒸馏操作时要用蒸馏烧瓶和直形冷凝管,并使用温度计测蒸汽温度,故D错误;
答案选B。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】硅、磷、硫、氯都是第三周期的非金属元素,它们在工农业生产中都有重要的用途。
(1) 基态硅原子的电子排布图为_________________________________________________;硫的基态原子能量最高的电子云在空间有________________个伸展方向,原子轨道呈________________形。
(2)硅、磷、硫的第一电离能由大到小的顺序为________________。
(3)单质磷与Cl2反应,可以生产PC13和PC15。其中各原子均满足8电子稳定结构的化合物中,P原子的杂化轨道类型为________________,其分子的空间构型为________________。
(4)H3PO4为三元中强酸,与Fe3+形成H3[Fe(PO4)2],此性质常用于掩蔽溶液中的Fe3+。基态Fe3+核外电子排布式为__________;PO43-作为___________为Fe3+提供________________。
(5)磷化硼(BP)是一种超硬耐磨涂层材料,下图为其晶胞,硼原子与磷原子最近的距离为a cm。 用Mg/mol表示磷化硼的摩尔质量,NA表示阿伏加德罗常数的值,则磷化硼晶体的密度为_________g/cm3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)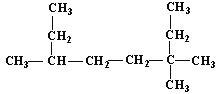 的名称为___________________________;
的名称为___________________________;
(2)A的化学式为C4H9Cl,已知A的核磁共振氢谱表明其只有一种化学环境的氢;则A的名称为________________________。
(3)2,4-二氯甲苯的结构简式为____________________________;
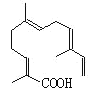
(4)某物质结构如图所示,碳原子数为_________________; 该物质可以与下列____________(填序号)发生反应。
A .KMnO4酸性溶液 B.氢气 C.溴水 D.NaOH溶液
(5)有机物A的结构简式为:![]() ,A在酸性条件下水解生成的芳香族化合物有多种同分异构体,请写出其中含有苯环(不含其它环状结构)、且能发生水解反应和银镜反应的所有同分异构体的结构简式(不包括立体异构)______________________________
,A在酸性条件下水解生成的芳香族化合物有多种同分异构体,请写出其中含有苯环(不含其它环状结构)、且能发生水解反应和银镜反应的所有同分异构体的结构简式(不包括立体异构)______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
人类文明的发展历程,也是化学物质的认识和发现的历程,其中铁、二氧化碳、青霉素、硝酸钾、乙醇、氨等“分子”改变过人类的世界。
(1)铁原子在基态时,外围电子排布式为____________。
(2)CO2的电子式为____________,1 mol CO2分子中含有σ键的物质的量为____________。
(3)6-氨基青霉烷酸的结构如图所示:
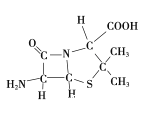
①其中C、N、O原子半径的大小关系为____________,电负性的大小关系为____________;
②其中采用sp3杂化的原子有C、____________。
(4)硝酸钾中NO3-的空间构型为____________,写出与NO3-互为等电子体的一种由前二周期元素原子构成的非极性分子化学式____________。
(5)乙醇的相对分子质量比氯乙烷小,但其沸点比氯乙烷高,其原因是____________。
(6)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,若两个最近的Fe原子间的距离为a cm,则该晶体的密度计算式为____________g/cm3(用NA表示阿伏加德罗常数)。
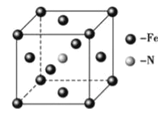
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】链状有机物A是一种食用型香精,在一定条件下有如下变化:
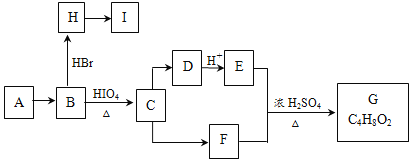
已知:(1)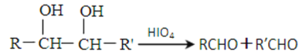
(2)A和G互为同分异构体,A不能使Br2的CCl4溶液褪色。B和F中所含官能团的类型相同。
完成下列填空:
(1)F的分子式为________________;C→D的反应类型是__________________________。
(2)A的结构简式为________________________________。
(3)若C中混有少量的E,请写出相应的除杂试剂和分离方法:________________。
(4)I中所有碳原子均在一条直线上,H转化为I的化学方程式为:______________________。
(5)X是A的一种同分异构体,1mol X在HIO4加热条件下完全反应,可以生成1mol无支链有机物,则X的结构简式为_________________。
(6)设计有1-丁烯为原料,合成H的合成路线。(合成路线常用的表示方式为:甲![]() 乙……
乙……![]() 目标产物)______________________________________
目标产物)______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莲花清瘟胶囊对新冠肺炎轻症状患者有显著疗效,其有效成分绿原酸存在如图转化关系,下列有关说法正确的是
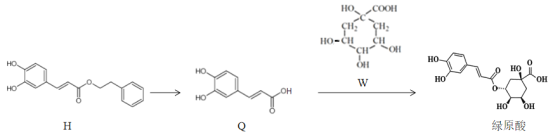
A.H的分子式为C17H14O4
B.Q中所有碳原子不可能都共面
C.1mol绿原酸与足量NaHCO3溶液反应,最多放出1molCO2
D.H、Q、W均能发生氧化反应、取代反应、显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3是中学实验室常用的试剂。
(1)写出氯化铁在水中的电离方程式:_________。
(2)利用氯化铁溶液制备氢氧化铁胶体。
①下列制备氢氧化铁胶体的操作方法正确的是_______(填字母)。
A.向饱和氯化铁溶液中滴加适量的氢氧化钠稀溶液
B.加热煮沸氯化铁饱和溶液
C.在氨水中滴加氯化铁浓溶液
D.在沸水中滴加饱和氯化铁溶液,煮沸至出现红褐色液体
②区别氯化铁溶液和氢氧化铁胶体的方法是___________。
(3)为了探究离子反应的本质,设计如下实验:
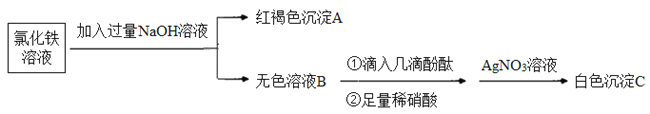
①写出生成A的离子方程式:_________。
②上述流程中,加入足量稀硝酸的目的是________。如何判定无色溶液B与稀硝酸发生了离子反应?________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是

A. 用经水湿润的pH试纸测量溶液的pH
B. 将4.0 g NaOH固体置于100 mL容量瓶中,加水至刻度,配制1.000 mol·L1NaOH溶液
C. 用装置甲蒸干AlCl3溶液制无水AlCl3固体
D. 用装置乙除去实验室所制乙烯中的少量SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是
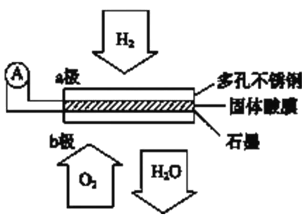
A. 电子通过外电路从b极流向a极
B. b极上的电极反应式为:O2+2H2O+4e--=4OH--
C. 每转移0.1mol电子,消耗1.12L的H2
D. H+由a极通过固体酸电解质传递到b极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com