
【题目】某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示。由图中数据

(1)该反应的化学方程式为_________________。
(2)反应开始至2min,用Z表示的平均反应速率为_____________。
(3)下列叙述能说明上述反应达到平衡状态的是_____________(填序号)。
A.X、Y、Z的物质的量之比为3∶1∶2
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗3molX,同时生成2molZ
D.混合气体的总质量不随时间的变化而变化
E.混合气体的总物质的量不随时间的变化而变
【答案】3X+Y≒2Z 0.05mol·L-1·min-1 BE
【解析】
(1) 从图像可知,X和Y物质的量分别减少0.3mol、0.1mol,做反应物,Z的物质的量增加0.2mol,根据反应中物质的量之比=系数之比,推断出方程式为:3X + Y![]() 2Z,故答案为:3X + Y
2Z,故答案为:3X + Y![]() 2Z;
2Z;
(2)2min时,v(Z)= ,故答案为:0.05mol·L-1·min-1;
,故答案为:0.05mol·L-1·min-1;
(3)A.物质的量成正比关系不能说明达到平衡状态,故A错误;
B.反应前后气体体积数不同,故压强不变时说明达到平衡状态,B正确;
C.消耗X正反应方向,生成Z也是正反应方向,不能说明达到平衡状态,C错误;
D.化学反应遵循质量守恒定律,故D错误;
E.混合气体的总物质的量不随时间的变化而变化,说明正反应速率=逆反应速率,故达到平衡状态,E正确;
故答案为:BE。


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】已知反应mX(g)+nY(g)qZ(g),△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列有关说法正确的是( )
A. 如果继续通入一定量某气体使体系压强增大,平衡将正向移动
B. 此时,X的正反应速率是Y的逆反应速率的π/n倍
C. 如果降低温度,且保持物质状态不发生改变,混合气体的平均相对分子质量变小
D. 如果增加X的物质的量,平衡正向移动,X的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热△H=-57.3 kJ·mol1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ·mol1
B. 甲烷的标准燃烧热ΔH=-890.3 kJ·mol1,则CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH<-890.3 kJ·mol1
C. 已知:500℃、30MPa下,N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4kJ·mol-1;将1.5 mol H2和过量的N2在此条件下充分反应,放出热量46.2 kJ
2NH3(g) ΔH=-92.4kJ·mol-1;将1.5 mol H2和过量的N2在此条件下充分反应,放出热量46.2 kJ
D. CO(g)的燃烧热是283.0kJ·mol1,则2CO2(g) ===2CO(g)+O2(g)反应的△H=+566.0 kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的A、B两种酸溶液各1 mL,分别加水稀释到1000 mL,其中pH与溶液体积V的关系如图所示。下列说法正确的是( )

A. A、B两酸溶液的物质的量浓度一定相等
B. 稀释后,A酸溶液的酸性比B酸溶液强
C. a=5时,A是强酸,B是弱酸
D. 若a小于5,则A、B都是弱酸,且A的酸性弱于B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列比较中,正确的是( )
A. 同温度同物质的量浓度时,HF比HCN易电离,则NaF溶液的pH比NaCN溶液大
B. 0.2 mol·L-1NH4Cl和0.1 mol·L-1NaOH溶液等体积混合后:c(![]() )>c(Cl-)>c(Na+)>c(OH-)>c(H+)
)>c(Cl-)>c(Na+)>c(OH-)>c(H+)
C. 物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-)
D. 同浓度的下列溶液中,①(NH4)2SO4、②NH4Cl、③CH3COONH4、④NH3·H2O;c(![]() )由大到小的顺序是:①>②>③>④
)由大到小的顺序是:①>②>③>④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里用如图所示装置制取纯净的无水CuCl2。试回答下列问题:

(1)写出烧瓶中发生反应的化学方程式和离子方程式:__________________________。
(2)B处盛有饱和食盐水(或水),其作用是_____________。
(3)C处盛放的试剂__________(填名称),其作用是_____________。
(4)E处盛有_______(填名称),发生反应的离子方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求填空:
(1)下列各组物质:
①金刚石和C60 ②H、D和T ③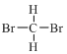 和
和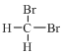 ④CH3(CH2)2CH3 和 (CH3)2CHCH3 ⑤正戊烷和异戊烷 ⑥(CH3)3CH2CH2CH3和CH3CH2CH2CH2CH3 ⑦H2O、T2O和D2O
④CH3(CH2)2CH3 和 (CH3)2CHCH3 ⑤正戊烷和异戊烷 ⑥(CH3)3CH2CH2CH3和CH3CH2CH2CH2CH3 ⑦H2O、T2O和D2O
互为同位素的是(填序号,下同)___,互为同素异形体的是______,互为同系物的是_____,属于同分异构体的是_______。
(2)书写下列物质的结构简式:
①2,6-二甲基-4-乙基辛烷:_________________
②2-甲基-1-戊烯:____________________
(3)按要求填空:
①分子式为C8H10的芳香烃,苯环上的一溴取代物只有一种,写出该芳香烃的结构简式: ______;
②C6H13Cl的同分异构体共有______种,请写出结构中仅含有四个甲基的所有同分异构体的结构简式:__________________。
③用系统命名法命名 ______________________________
______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度是2.18g/cm3,沸点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验中可以用如图所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液。试管d中装有浓溴水(表面覆盖少量水)。

请填写下列空白:
(1)烧瓶a中发生的是乙醇的脱水反应,即消去反应,反应温度是170℃,并且该反应要求温度迅速升高到170℃,否则容易发生副反应。请写出乙醇发生消去反应的方程式 ____________。
(2)写出制备1,2-二溴乙烷的化学方程式:____________。
(3)安全瓶b可以防止倒吸,并可以检査实验进行时试管d是否发生堵塞,请回答发生堵塞时瓶b中的现象:___________________。
(4)容器c中NaOH溶液的作用是:_________________。
(5)若产物中有少量副产物乙醚,可用_______________________的方法除去;
(6)反应过程中应用冷水冷却装置d,其主要目的是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂排放的污水只可能含Na+、K+、NH4+、Mg2+、Fe3+、SO32-、SO42-和Cl-中的几种(忽略由水电离产生的H+、OH-)。将试样平均分成甲、乙、丙各l00mL三份,每次均加入足量的试剂,设计如下实验。下列说法正确的是( )

A. 废水可能含有Na+、K+、Fe3+
B. 可能存在的离子用焰色反应进一步检验确认
C. 废水一定含有Cl-、SO42-和Mg2+,且c(Cl-)=0.2mol·L-1
D. 废水一定不含 SO32-、Cl-、NH4+、Na+、K+、Fe3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com