
【题目】过氧乙酸又名过醋酸![]() ,是重要化工原料,也是一种绿色生态杀菌剂,其制法为
,是重要化工原料,也是一种绿色生态杀菌剂,其制法为![]() 。
。
(1)某同学写出了碳原子的4种不同状态的电子排布图:
a.![]() b.
b.![]()
c.![]() d.
d.![]()
其中能量最低的是________(填标号),电子由状态C到状态B所得到的光谱为________光谱(填“原子发射”或“原子吸收”)。
(2)过氧乙酸分子中C原子的杂化方式有________。
(3)乙酸比乙醇易电离出![]() 的原因____________________。
的原因____________________。
(4)熔点:乙酸________硝酸(填“>”、“<”或“=”),理由_________________。
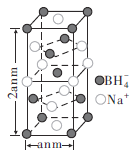
(5)造纸中,用![]() 与纸浆中的过氧乙酸以及过渡金属离子反应以提高漂白效率。硼氢化钠、硼氢化铝被认为是有机化学上的“万能还原剂”。
与纸浆中的过氧乙酸以及过渡金属离子反应以提高漂白效率。硼氢化钠、硼氢化铝被认为是有机化学上的“万能还原剂”。
①两种硼氢化物的熔点如下表所示:
硼氢化物 |
|
|
熔点/℃ | 400 | -64.5 |
解释表中两种物质熔点差异的原因________。
②硼氢化钠晶胞结构如图所示,该晶体中![]() 的配位数为________。已知:硼氢化钠晶体的密度为
的配位数为________。已知:硼氢化钠晶体的密度为![]() ,
,![]() 代表阿伏伽德罗常数的值,则a=________nm(用含
代表阿伏伽德罗常数的值,则a=________nm(用含![]() 、
、![]() 的最简式子表示)。
的最简式子表示)。
【答案】A 原子发射 ![]() 、
、![]() 由于O的电负性大于C,乙酸分子上碳氧双键上的C原子带部分正电荷使碳氧单键的电子发生偏移导致氢氧键极性变大,所以在水分子的作用下乙酸比乙醇易电离出
由于O的电负性大于C,乙酸分子上碳氧双键上的C原子带部分正电荷使碳氧单键的电子发生偏移导致氢氧键极性变大,所以在水分子的作用下乙酸比乙醇易电离出![]() > 硝酸形成的是分子内氢键而乙酸形成的是分子间氢键,乙酸熔融时需要消耗较多的能量克服分子间氢键,所以乙酸的熔点高于硝酸 硼氢化钠是离子晶体而硼氢化铝是分子晶体,离子晶体的熔点高 8
> 硝酸形成的是分子内氢键而乙酸形成的是分子间氢键,乙酸熔融时需要消耗较多的能量克服分子间氢键,所以乙酸的熔点高于硝酸 硼氢化钠是离子晶体而硼氢化铝是分子晶体,离子晶体的熔点高 8 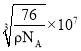
【解析】
(1)根据核外电子排布规律,A排布为基态,能量最低。当原子中的电子从高能级跃迁到低能级释放能量得到原子发射光谱,从低能级跃迁到高能级吸收能量得到原子吸收光谱。状态C中高能级电子数比状态B多,能量高,电子由状态C到状态B释放能量故所得光谱为原子发射光谱。
(2)过氧乙酸的分子结构式为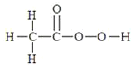 ,可知分子中的两个C原子的共价键数分别为4和3且无孤电子对,所以C原子的杂化方式有
,可知分子中的两个C原子的共价键数分别为4和3且无孤电子对,所以C原子的杂化方式有![]() 和
和![]() 两种。
两种。
(3)由于O的电负性大于C,乙酸分子上碳氧双键上的C原子带部分正电荷,碳氧单键的电子发生偏移导致氢氧键极性变大,所以在水分子的作用下乙酸比乙醇易电离出![]() (或在溶液中
(或在溶液中![]() 比
比![]() 稳定,所以乙酸比乙醇易电离出
稳定,所以乙酸比乙醇易电离出![]() )。
)。
(4)两者均为分子晶体,但是硝酸形成的是分子内氢键而乙酸形成的是分子间氢键,乙酸熔融时需要消耗较多的能量克服分子间氢键,所以乙酸的熔点高于硝酸。
(5)①硼氢化钠是由活泼金属离子与硼氢根离子组成,属于离子晶体,而硼氢化铝熔点为-64.5℃属分子晶体,微粒间作用力弱,离子晶体的熔点高。
②晶胞拓展为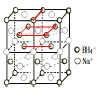 可知晶体中
可知晶体中![]() 的配位数为8,晶体的密度
的配位数为8,晶体的密度![]() ,晶胞的体积
,晶胞的体积![]() ,因此晶胞的边长
,因此晶胞的边长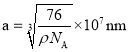 。
。


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案科目:高中化学 来源: 题型:
【题目】下列实验中,现象及得出的结论正确的是()
实验 | 现象 | 结论 | |
A |
| 试管(1)中紫色褪去, 试管(2)中紫色未褪 | 甲基使苯环的活性增强 |
B |
| 试管内壁有 银镜生成 | 有机物X中一定含有醛基 |
C | 向淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的氢氧化铜悬浊液并加热 | 未见砖红色沉淀 | 淀粉未水解 |
D |
| 最后一只试管中有浅黄色沉淀 | 有机物中含有溴原子 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某固体有机物A的分子组成,测定装置如图(铁架台、铁夹、酒精灯等未画出):
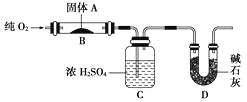
取17.1 g A放入装置中,通入过量O2燃烧,生成CO2和H2O,请回答下列有关问题:
(1)通入过量O2的目的是______________________________________________。
(2)C装置的作用是__________________________________________;
D装置的作用是_____________________________________________。
(3)通过该实验,能否确定A中是否含有氧原子?________。
(4)若A的摩尔质量为342 g/mol,C装置增重9.99 g,D装置增重26.4 g,则A分子式为____________。
(5)写出A燃烧的化学方程式_____________________________________。
(6)A可发生水解反应,1 mol A可水解生成2 mol同分异构体,则A在催化剂作用下水解的化学方程式为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组在研究前18号元素时发现:依据不同的标准和规律,元素周期表有不同的排列形式。如果将它们按原子序数递增的顺序排列,可形成如图所示的“蜗牛”形状,图中每个“”代表一种元素,其中P点代表氢元素。下列说法不正确的是( )
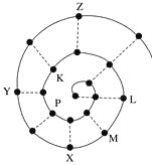
A. 图中虚线相连的元素位于同一族
B. P、K、L、M、X、Y、Z都是短周期元素
C. K元素位于常规周期表的第三周期第ⅥA族
D. M与Z 两种元素形成的化合物的化学式为MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。
Ⅰ.化学上采用![]() 处理
处理![]() 不仅可以消除污染,还可作为工业生产的能量来源。
不仅可以消除污染,还可作为工业生产的能量来源。
(1)工业上可采用![]() 的方法合成氨。我国学者采用量子力学方法,通过计算机模拟,研究了在催化剂表面上合成氨的反应历程。图1为各步反应的能量变化示意图,其中“吸”表示各气态物质在催化剂表面吸附。
的方法合成氨。我国学者采用量子力学方法,通过计算机模拟,研究了在催化剂表面上合成氨的反应历程。图1为各步反应的能量变化示意图,其中“吸”表示各气态物质在催化剂表面吸附。
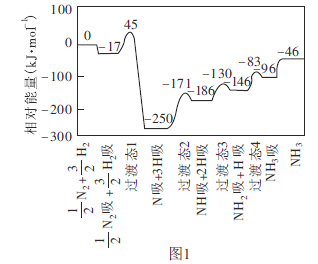
①该反应历程中正反应的最大活化能为________![]() 。
。
②合成氨反应的热化学方程式为_________________。
(2)不同温度下,向三个容器中分别投入相同量的反应物进行反应,测得不同压强下平衡混合物中![]() 的物质的量分数如图2所示。
的物质的量分数如图2所示。
①M点的![]() ________N点的
________N点的![]() (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
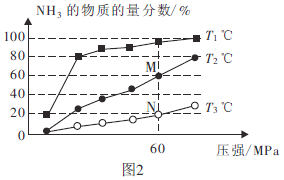
②![]() ℃时,将
℃时,将![]()
![]() 和
和![]()
![]() 充入2L的密闭容器中,维持压强为60MPa不变,达到N点的平衡状态,化学平衡常数K=________
充入2L的密闭容器中,维持压强为60MPa不变,达到N点的平衡状态,化学平衡常数K=________![]() (用最简分数表示)。
(用最简分数表示)。
Ⅱ.废水中的氮常以含氮有机物、氨、硝酸盐及亚硝酸盐等形式存在。
(3)①用次氯酸钠除去氨氮(以![]() 示)的原理如图3所示。写出总反应的化学方程式:______________。
示)的原理如图3所示。写出总反应的化学方程式:______________。
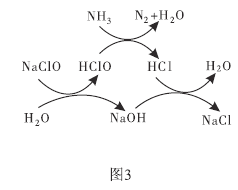
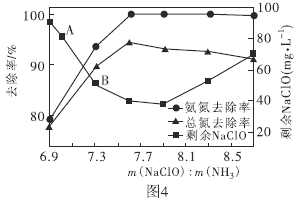
②取一定量的含氨氮废水,改变加入次氯酸钠的用量,反应相同时间后,溶液中氨氮去除率、总氮(溶液中所有可溶性的含氮化合物中氮元素的总量)去除率以及剩余次氯酸钠的含量随![]() 的变化情况如图4所示。当
的变化情况如图4所示。当![]() 时,水体中总氮去除率反而下降,可能的原因是________。
时,水体中总氮去除率反而下降,可能的原因是________。
(4)近年来,水体中的硝酸盐含量不断增加。工业上去除废水中硝酸盐的方法是采用电解法将![]() 转化为
转化为![]() ,部分装置如图5所示。
,部分装置如图5所示。
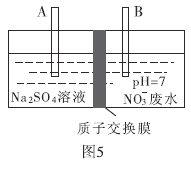
①B电极的电极反应式是________.
②常温下,除去10L废水中的![]()
![]() 后,最终废水的
后,最终废水的![]() ________(电解前后废水的体积变化忽略不计)。
________(电解前后废水的体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用软锰矿及含锰废料(主要成分![]() ,含有少量
,含有少量![]() 等)与烟气脱硫进行联合处理并制备
等)与烟气脱硫进行联合处理并制备![]() 的流程如下:
的流程如下:
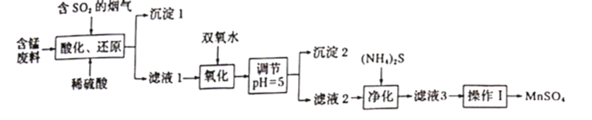
25℃时,几种金属离子沉淀时的pH如下:
|
|
|
|
| |
开始沉淀时pH | 7.6 | 2.7 | 3.8 | 8.3 | 5.9 |
完全沉淀时pH | 9.7 | 4.0 | 4.7 | 9.8 | 6.9 |
(1)![]() 在酸化还原步骤中所发生反应的离子方程式分别为_____________、_____________。
在酸化还原步骤中所发生反应的离子方程式分别为_____________、_____________。
(2)沉淀1为_________(填化学式),用双氧水处理滤液1时,通常在40~55℃下进行原因是_____________。
(3)氧化反应过程中常会有一定量的气泡产生,可能的原因是___________,调节溶液![]() 的目的是_______________
的目的是_______________
(4)“净化”时,加入![]() 的作用是______________
的作用是______________
(5)滤液3中除![]() 外,还含有少量
外,还含有少量![]() 。
。![]() 的溶解度曲线如图所示。据此判断,“操作I”应为___________、______、洗涤、干燥。
的溶解度曲线如图所示。据此判断,“操作I”应为___________、______、洗涤、干燥。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取Cl2的反应:
4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O。下列说法不正确的是( )
MnCl2+Cl2↑+2H2O。下列说法不正确的是( )
A.氧化剂是MnO2,还原剂是HCl
B.每生成1 mol Cl2,转移电子的物质的量是2 mol
C.每消耗1 mol MnO2,表现还原作用的HCl为4 mol
D.Cl2是氧化产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氧化碳和氢气是重要的化工原料,常用于合成甲醇、二甲醚、甲酸甲酯等有机物。
(1)已知![]() 的燃烧热分别是
的燃烧热分别是![]() ,则甲醇与一氧化碳催化合成乙酸的热化学方程式为_____________。
,则甲醇与一氧化碳催化合成乙酸的热化学方程式为_____________。
(2)有人设想将![]() 按下列反应除去
按下列反应除去![]() ,该反应能否自发进行______________(填“是”或“否”),依据是_____________。
,该反应能否自发进行______________(填“是”或“否”),依据是_____________。
(3)向体积可变的密闭容器中投入![]() 和
和![]() ,在不同条件下发生反应:
,在不同条件下发生反应:![]() 。测得
。测得![]() 的平衡转化率随温度、压强的变化如图所示。
的平衡转化率随温度、压强的变化如图所示。
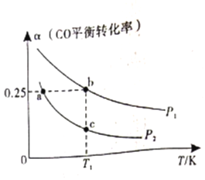
①该可逆反应的![]() __________0(填>”、“<”或“=”)。a、b、c三点对应的平衡常数
__________0(填>”、“<”或“=”)。a、b、c三点对应的平衡常数![]() 的大小关系是____________________。
的大小关系是____________________。
②在恒温恒容条件下进行该反应,能表示反应达到平衡状态的是______________(填字母)。
a. CO的体积分数保持不变
b. 容器内混合气体的密度保持不变
c.容器内混合气体的平均摩尔质量保持不变
d.单位时间内消耗CO的浓度等于生成![]() 的浓度
的浓度
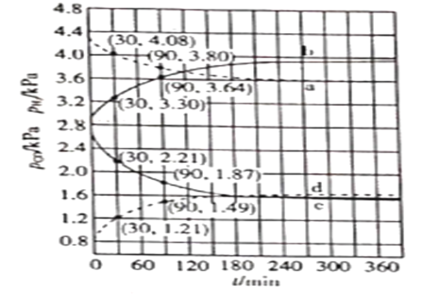
(4)在催化剂作用下,![]() 时分别进行反应:
时分别进行反应:![]() ,
,![]() ,测得CO和
,测得CO和![]() 的分压随时间的变化关系如图所示。起始时,体系中
的分压随时间的变化关系如图所示。起始时,体系中![]() 和
和![]() 相等、
相等、![]() 和
和![]() 相等。计算曲线a的反应在
相等。计算曲线a的反应在![]() 内的平均速率
内的平均速率![]() _______
_______![]() 。
。![]() 时
时![]() 随时间变化关系的曲线是_______,
随时间变化关系的曲线是_______,![]() 时
时![]() 随时间变化关系的曲线是___________。
随时间变化关系的曲线是___________。
(5)一定条件下,![]() 与粉末状氢氧化钠反应生成甲酸钠。已知:常温时,甲酸的电离平衡常数
与粉末状氢氧化钠反应生成甲酸钠。已知:常温时,甲酸的电离平衡常数![]() 。向
。向![]() 的甲酸钠溶液中加入
的甲酸钠溶液中加入![]() 的盐酸,混合液呈__________性(填“酸”或“碱”),溶液中离子浓度从大到小的顺序为__________________。
的盐酸,混合液呈__________性(填“酸”或“碱”),溶液中离子浓度从大到小的顺序为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述中正确的是( )
A.化学反应速率的关系是2υ逆(NH3)=3υ正(H2O)
B.恒容时,混合气体的平均密度保持不变的时候,可以证明达到平衡
C.达到化学平衡时,若增大容器的体积,则正反应速率减小,逆反应速率增大
D.达到化学平衡时4υ正(O2)=5υ逆(NO)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com