
【题目】[化学一一选修5:有机化学基础]
有机化合物K是有机合成中的一种重要的中间体,K的合成路线如下(部分产物及条件略去):

已知:
(1)A的核磁共振氢谱只有一组峰,A中官能团的名称为___________。
(2)B→C和(D+H)→K的反应类型分别是___________、___________。
(3)H的结构简式为___________。
(4)D的系统命名为___________。
(5)G→I的第①步反应方程式为___________;I→J的反应方程式为___________。
(6)同时满足下列条件的K的同分异构体有___________种(不考虑立体异构,也不包括K)。
①与K具有相同的官能团 ②分子中有一个甲基 ③具有六元碳环结构
(7)参照上述合成路线,设计一条由乙醛和乙炔为原料制备![]() 的合成路线(无机试剂任选):
的合成路线(无机试剂任选):![]() ___________。
___________。
【答案】羰基 消去反应 加成反应 CH2=CHCHO 2-甲基-1,3-丁二烯 CH2(OH)CH2CHO+2Cu(OH)2+NaOH![]() CH2(OH)CH2COONa+Cu2O↓+3H2O
CH2(OH)CH2COONa+Cu2O↓+3H2O ![]() 16
16 ![]()
【解析】
A的分子式C3H60,核磁共振氢谱只有一组峰,则A为丙酮; 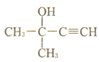 脱掉1分子水生成
脱掉1分子水生成![]() ,C是
,C是![]() ,
,![]() 与氢气发生加成反应生成
与氢气发生加成反应生成![]() ;根据K(
;根据K(![]() )逆推H是CH2=CHCHO;由CH2=CHCHO逆推G是CH2(OH)CH2CHO;根据
)逆推H是CH2=CHCHO;由CH2=CHCHO逆推G是CH2(OH)CH2CHO;根据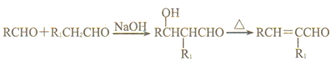 ,由E和F生成CH2(OH)CH2CHO,可知E是CH3CHO、F是HCHO;CH2(OH)CH2CHO被新制氢氧化铜氧化为I,则I是CH2(OH)CH2COOH;CH2(OH)CH2COOH发生缩聚反应生成J,J是
,由E和F生成CH2(OH)CH2CHO,可知E是CH3CHO、F是HCHO;CH2(OH)CH2CHO被新制氢氧化铜氧化为I,则I是CH2(OH)CH2COOH;CH2(OH)CH2COOH发生缩聚反应生成J,J是![]() 。
。
(1)A的分子式C3H60,核磁共振氢谱只有一组峰,则A为丙酮,官能团名称为羰基;
(2) →
→![]() 为消去反应,CH2=CHCHO与
为消去反应,CH2=CHCHO与![]() 发生加成反应生成
发生加成反应生成![]() ;
;
(3)H的结构简式为CH2=CHCHO;
(4)D是![]() ,系统命名为2-甲基-1, 3-丁二烯;
,系统命名为2-甲基-1, 3-丁二烯;
(5)CH2(OH)CH2CHO与新制氢氧化铜反应的方程式为:CH2(OH)CH2CHO+2Cu(OH)2+NaOH![]() CH2(OH)CH2COONa+Cu2O↓+3H2O, CH2(OH)CH2COOH含有羟基、羧基发生缩聚反应生成高聚物
CH2(OH)CH2COONa+Cu2O↓+3H2O, CH2(OH)CH2COOH含有羟基、羧基发生缩聚反应生成高聚物![]() ,反应方程式是
,反应方程式是![]() ;
;
(6)满足条件的K的同分异构体,若醛基连在碳碳双键上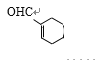 ,则甲基连接方式有5种;若醛基不与碳碳双键上的碳原子相连
,则甲基连接方式有5种;若醛基不与碳碳双键上的碳原子相连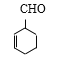 ,则甲基连接方式有6种;若醛基连接方式与K相同时
,则甲基连接方式有6种;若醛基连接方式与K相同时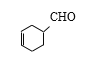 ,则甲基连接方式有5种(除K外),共16种。
,则甲基连接方式有5种(除K外),共16种。
(7)乙醛与乙炔在氢氧化钾存在的条件下生成![]() ,
,![]() 在氧化铝存在的条件下生成
在氧化铝存在的条件下生成![]() ,
,![]() 与氢气发生加成反应生成
与氢气发生加成反应生成![]() ,两分子
,两分子![]() 发生加成反应生成
发生加成反应生成![]() ,合成路线是
,合成路线是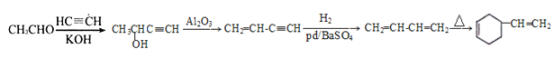 。
。


科目:高中化学 来源: 题型:
【题目】已知反应H2(g)+ I2(g)![]() 2HI(g),1 mol H2完全反应放出a kJ的热量,依据下表数据,以下说法错误的是( )
2HI(g),1 mol H2完全反应放出a kJ的热量,依据下表数据,以下说法错误的是( )
化 学 键 | H—H | I—I |
断开1 mol化学键时吸收的能量(kJ) | b | c |
A.该反应中反应物的总能量高于生成物的总能量
B.断开1 mol H-H 键和1 mol I-I 键所需能量大于断开2 mol H-I 键所需能量
C.断开2 mol H-I键所需能量为(a+b+c)kJ
D.向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 标准状况下,22.4 L C2H6O含有的O-H键数目为NA
B. 100 g 质量分数17%H2O2溶液中极性键数目为NA
C. 65 g Zn与足量浓硫酸充分反应得混合气体的分子数为NA
D. 1 L 0.1 mol/L K2Cr2O7溶液中含铬的离子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 1L0.1mol/L的 NaHSO4溶液中所含的氧原子数目为0.4NA
B. 1mol-OH(羟基)与1 mol H3O+中所含的电子数均为10NA
C. 7.1gCl2与足量Fe充分反应,转移的电子数为0.2NA
D. 80gCuO和Cu2S的混合物中,所含铜原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个容积为2 L 的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。根据图中数据,填写下列空白:

(1)该反应的化学方程式为:______________________。
(2)反应开始至2 min,气体Z的平均反应速率v(Z)=____________。
(3)1min时,正逆反应速率的大小关系为:v正____________v逆(填“>”、“<”或“=”);4min时,v正____________v逆(同前);若X、Y、Z均为气体,反应达到平衡时:若此时将容器的体积缩小为原来的1/2倍,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为________反应(填“放热”或“吸热”)。
(4)上述反应在t1~t6内反应速率与时间图像如图,在每一时刻均改变一个影响反应速率的因素,则下列说法正确的是____________。

A.在t1时增大了压强
B.在t3时加入了催化剂
C.在t4时降低了温度
D.t2~t3时X的转化率最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiSO4![]() 6H2O易溶于水,其溶解度随温度升高明显增大。以电镀废渣(主要成分是NiO,还有CuO、FeO等少量杂质)为原料制备该晶体的流程如下,下列说法错误的是
6H2O易溶于水,其溶解度随温度升高明显增大。以电镀废渣(主要成分是NiO,还有CuO、FeO等少量杂质)为原料制备该晶体的流程如下,下列说法错误的是
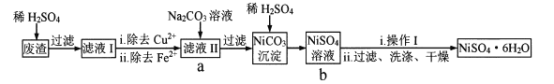
A. 溶解废渣时不能用稀盐酸代替稀H2SO4B. 除去Cu2+可采用FeS
C. 流程中a-b的目的是富集NiSO4D. “操作I”为蒸发浓缩、冷却结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2+O2![]() 2SO3是工业制硫酸的一步重要反应,下列说法正确的是
2SO3是工业制硫酸的一步重要反应,下列说法正确的是
A. 使用催化剂能改变该反应限度
B. 减小SO2的浓度能加快该反应的速率
C. 升高体系温度能加快反应速率
D. 1 mol SO2和足量的O2在一定条件下充分反应,生成1 mol SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在定温定容下的反应:2AB(g)![]() 3A2(g)+B2(g),能说明此反应达到平衡是
3A2(g)+B2(g),能说明此反应达到平衡是
A.混合气体的平均摩尔质量不再随时间的变化而变化
B.混合气体的密度不再随时间的变化而变化
C.AB的消耗速率等于A2的消耗速率
D.单位时间内生成3nmolA2,同时消耗2nmolAB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定条件下,恒压容器中发生反应:2X(g)+Y(g)![]() 2Z(g), △H=-akJ·mol-1(a>0)。下列说法不正确的是
2Z(g), △H=-akJ·mol-1(a>0)。下列说法不正确的是
A. 单位时间内生成2n mol X,同时生成nmol Y
B. 混合体系的密度不再变化,说明该反应达到化学平衡状态
C. 反应过程中,X和Z的物质的量之和保持不变
D. 向容器中加入0.2 mol X与0.1 molY充分反应,放出热量为0.lakJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com