
下列试剂中,能用来鉴别FeCl3的最佳试剂是
A.NaNO3溶液 B.稀硫酸
C.KSCN溶液 D.酸性KMnO4溶液
科目:高中化学 来源:2014-2015湖南省怀化市小学课改高二上学期期末化学试卷(解析版) 题型:选择题
100 ℃时,水的离子积为1×10-12 ,若该温度下某溶液中的H+浓度为1×10-7 mol·L-1,则该溶液呈
A.酸性 B.碱性 C.中性 D.无法判断
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省广州市高一上学期期末化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.1 mol CO2 的质量为44g/mol
B.H2SO4的摩尔质量为98
C.标准状况下,气体摩尔体积约为22.4 L
D.O2的相对分子质量为32
查看答案和解析>>
科目:高中化学 来源:2014-2015北京市昌平区高一上学期期末考试化学试卷(解析版) 题型:选择题
对于反应Fe+2H+ ══ Fe2++ H2↑ 认识不正确的是
A.该反应属于氧化还原反应
B.该反应属于置换反应
C.该反应可以表示Fe与硝酸的反应
D.该反应利用H+氧化了铁单质
查看答案和解析>>
科目:高中化学 来源:2014-2015北京市昌平区高一上学期期末考试化学试卷(解析版) 题型:选择题
下列反应的离子方程式正确的是
A.溴水与碘化钾溶液:Br2 + 2I-  2Br- + I2
2Br- + I2
B.钠与水:Na + H2O  Na+ + OH-+ H2↑
Na+ + OH-+ H2↑
C.碳酸钙与稀盐酸:CO32- + 2H+  CO2↑+ H2O
CO2↑+ H2O
D.硫酸铜溶液与氢氧化钡溶液:Cu2+ + 2OH-  Cu(OH)2↓
Cu(OH)2↓
查看答案和解析>>
科目:高中化学 来源:2014-2015北京市昌平区高一上学期期末考试化学试卷(解析版) 题型:选择题
当光束通过下列分散系时,可观察到丁达尔效应的是
A.NaCl溶液 B.H2SO4溶液 C.CuSO4溶液 D.Fe(OH)3胶体
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市黄浦区高三上学期期末调研测试化学试卷(解析版) 题型:实验题
(本题共11分)下图是制备二氧化硫制取和吸收装置(加热装置已省略)

分液漏斗中是液体反应试剂A,烧瓶中盛反应试剂B。完成下列填空:
32.实验室制备二氧化硫的试剂是 和 。
33.检验该气体发生装置气密性的方法是 。
34.装置C是吸收多余二氧化硫的装置,其中盛放的吸收剂为 ,实验结束进行尾气吸收时,对活塞开关K1、K2的控制是 。
35.如果用该套装置制备盐酸,此时C瓶所加试剂为 ,此时C中液体可能会发生倒吸,如果不改变现有的装置,要克服这一安全隐患,可以在C瓶中再加入有机试剂封住长导管管口,该有机试剂可以为___________,吸收后,将 C瓶中的液体经过 操作获得盐酸。
36.甲同学用该装置测定一定质量小苏打样品(含少量NaCl)中碳酸氢钠的纯度,可以在C中加入氢氧化钠溶液吸收二氧化碳,通过C瓶增重得到二氧化碳质量,计算出碳酸氢钠的含量,实验结果小苏打含量偏低,你认为实验结果偏低的原因是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市黄浦区高三上学期期末调研测试化学试卷(解析版) 题型:选择题
有四组同一族元素所形成的不同物质,在101kPa时测定它们的沸点(℃)如下表所示:
第一组 | A -268.8 | B -249.5 | C -185.8 | D -151.7 |
第二组 | F2 -187.0 | Cl2 -33.6 | Br2 58.7 | I2 184.0 |
第三组 | HF 19.4 | HCl -84.0 | HBr -67.0 | HI -35.3 |
第四组 | H2O 100.0 | H2S -60.2 | H2Se -42.0 | H2Te -1.8 |
下列各项判断正确的是
A.第四组物质中H2O的沸点最高,是因为H2O分子中化学键键能最强
B.第三组与第四组相比较,化合物的稳定性顺序为:HBr>H2Se
C.第三组物质溶于水后,溶液的酸性:HF>HCl>HBr>HI
D.第一组物质是分子晶体,一定含有共价键
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市静安区高三上学期期末考试化学试卷(解析版) 题型:计算题
(本题共14分)
铝是第二金属,是地壳中含量最多的金属,用途广泛。
51.将某铝土精矿R(Al2O3、Fe2O3)粉末48.8g加入含1mol NaOH的溶液中,发生的反应为:
Al2O3(s)+2NaOH(aq)+ 2H2O(l)→2NaAl(OH)4(aq)
充分反应后,过滤、洗涤、干燥,得到8.0g固体,则该精矿Al2O3的质量分数为 (精确到0.001)。
往滤液中通入CO2,发生的反应为: 2NaAl(OH)4 + CO2→2Al(OH)3↓+ Na2CO3+ H2O,若生成0.5 mol Na2CO3,则生成Al(OH)3 mol。
52.有反应Al2O3(s)+ Na2CO3(s)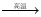 2NaAlO2(s)+ CO2(g)
2NaAlO2(s)+ CO2(g)
2NaAlO2(aq)+ CO2(g) +3H2O→2Al(OH)3↓+ Na2CO3
若以铝土精矿R和Na2CO3为原料,除得到Al2O3外,还得到“赤泥”,其成分为(金属元素均以氧化物形式表示):
Al2O3 | Fe2O3 | Na2O | |
质量分数 | 0.065 | 0.850 | 0.029 |
每1t铝土精矿生产时:得到的赤泥 t(精确到0.001,下同);可制得Al2O3得 t;需要补充购买Na2CO3 kg。
53.取a g Al2O3加入溶质的质量分数为b的硫酸溶液中,充分反应后再往溶液加入一定量的(NH4)2SO4,加热、搅拌,冷却后全部溶液正好转化为45.3 g铝铵矾晶体[NH4Al(SO4)2·12H2O,式量:453],则a= ;
求b的值(精确到0.001):
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com