
����Ŀ�����ܱ���Ϊ��߷��w���������Դ���������ʹ���������������õ���Ҫ�о�������ش��������⣺
��.������A(H3BNH3)��һ��DZ�ڵĴ�����ϣ�������Ԫ��״����(HB=NH)3ͨ���� �·�Ӧ�Ƶ�:3CH4+2 (HB=NH) 3+6H2O=3CO2+6H3BNH3
(1)��̬Bԭ�ӵļ۵����Ų�ʽΪ___________��B��C�� N�� O��һ�������ɴ�С��˳��Ϊ_________��CH4��H2O��CO2�ļ��ǰ����ɴ�С��˳������Ϊ___________��
(2)��(HB=NH)3����Ϊ�ȵ�������л�����Ϊ___________(�����ʽ)��
��.�����İ�ȫ���������������Ӧ�õĹؼ���
(1)ӡ�����³�Ƚ���ѧ������ĵ�Datta��Pati���˽���ADF������һ���� �ͻ�ϩ�ഢ�����(C16S8)������峣������۽Ƕ�֤�����ֲ��ϵķ��ӳ�ƽ��ṹ(��ͼ)��ÿ���ӻ�ƽ������������������10��H2���ӡ�

��C16S8������Cԭ�Ӻ�Sԭ�ӵ��ӻ�������ͷֱ�Ϊ___________��
����ؼ������������ʾ��
��ѧ�� | C-S | C=S | C16S8��̼��� |
����/pm | 181 | 155 | 176 |
�ӱ������ݿ�����C16S8��̼�����������C��S����C=S��֮�䣬ԭ�����______________________��
��C16S8��H2�������������___________��
(2)�д���ܵ�ͭ�Ͻ�������������ܶѻ��ṹ��������Cuԭ��λ�����ģ�Ag ԭ��λ�ڶ��㣬��ԭ�ӿɽ�����Cuԭ����Agԭ�ӹ��ɵ��������϶�С��þ��崢���ľ����ṹ��CaF2(��ͼ)���ƣ��þ��崢���Ļ�ѧʽΪ___________��


(3)MgH2�ǽ����⻯�ﴢ����ϣ��侧������ͼ��ʾ���þ�����ܶ�Ϊagcm-3���������Ϊ___________cm3(�ú�a��NA�Ĵ���ʽ��ʾ��NA��ʾ�����ӵ�������ֵ)��
���𰸡�2s22p1 N>O>C>B CO2>CH4>H2O sp2��sp3 C6H6 C16S8�����е�̼�������һ���̶ȵ�˫������ ���»��� Cu3AgH8 ![]()
��������
��(1)B��ԭ������Ϊ5�����ݵ����Ų�����1s22s22p1���۵����Ų�Ϊ2s22p1��B��C��N��Oͬ����Ԫ�أ����һ������Խ��Խ����Ҫ���ǵ�����״̬��N�ļ۵����Ų�Ϊ2s22p3��Ϊ���������ȶ��������ܻ�ϴ������Ų�ΪN>O>C>B�����ݷ��ӹ����Լ����ӶԻ������ۣ�CO2Ϊֱ���ͷ��ӣ�����Ϊ180�㣬CH4Ϊ�������壬����Ϊ109.5�㣬H2O��O�ŶԵ��ӻ�����O��H����ѹ�����ǻ�С��109.5�㣬���Լ��ǵ�����ΪCO2>CH4>H2O����Ϊ2s22p1 N>O>C>B CO2>CH4>H2O��
��2���ȵ����壬�۵��Ӻ�ԭ��������ȡ��л����к���C��ǡ��B��Nԭ�ӣ��ڼ۵��Ӻ�ԭ�����������2��Cԭ�ӣ���ȵ�����Ϊ(C2H2)3��ΪC6H6����ΪC6H6��
��(1) ��ÿ��Cԭ����Χ��3��Cԭ�ӣ���3���Ҽ���1���м���Cԭ�ӵ��ӻ�����Ϊsp2��ÿ��Sԭ���ܱ���2����������2�Թ¶Ե��ӣ��ӻ�����Ϊsp3����Ϊsp2��sp3��
��C16S8��̼�����������C��S����C=S��֮�䣬C16S8�����е�̼�������һ���̶ȵ�˫�����ʣ������ü������ڵ�����˫��֮�䣬��ΪC16S8�����е�̼�������һ���̶ȵ�˫�����ʣ�
��C16S8��H2��Ϊ���ӣ����Ӽ��������Ϊ���»�������Ϊ���»�����
(2) ������Cuԭ��λ�����ģ�Ag ԭ��λ�ڶ��㣬��ԭ�ӿɽ�����Cuԭ����Agԭ�ӹ��ɵ��������϶�У���ͼ�п��ĵ�ȦΪ���ص�Hԭ�ӣ����㾧���е�ԭ�ӣ�Cuԭ��λ�����ģ�Ϊ2�����������У���ÿ����������![]() ��Cuԭ�ӡ�ÿ��������Ag ԭ��λ�ڶ��㣬Ϊ8�����������У���
��Cuԭ�ӡ�ÿ��������Ag ԭ��λ�ڶ��㣬Ϊ8�����������У���![]() ��Agԭ�ӣ����ĵ�Ȧ�ھ����У�Ϊ��������ӵ�У�ÿ��������8��Hԭ�ӣ���ѧʽΪCu3AgH8����ΪCu3AgH8��
��Agԭ�ӣ����ĵ�Ȧ�ھ����У�Ϊ��������ӵ�У�ÿ��������8��Hԭ�ӣ���ѧʽΪCu3AgH8����ΪCu3AgH8��
(3)����![]() �����ݾ����ṹ��������������1��Mg��Ϊ�����������У� 8��������8��Mgԭ�ӣ�Ϊ8���������У���һ����
�����ݾ����ṹ��������������1��Mg��Ϊ�����������У� 8��������8��Mgԭ�ӣ�Ϊ8���������У���һ����![]() ��Mgԭ�ӡ������⻯�ﴢ����ϵĻ�ѧʽΪMgH2����ÿ��������2��Mgԭ�ӣ�4��Hԭ�ӡ�
��Mgԭ�ӡ������⻯�ﴢ����ϵĻ�ѧʽΪMgH2����ÿ��������2��Mgԭ�ӣ�4��Hԭ�ӡ�![]() ��
��![]() ��
��![]() ����Ϊ
����Ϊ![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���װ�(CH3NH2)�Ǻϳ�̫������������ԭ�ϡ�һ���¶��£������������Ϊ2.0 L�ĺ����ܱ������а���ͬ��ʽͶ�뷴Ӧ�������ӦCH3OH(g)��NH3(g) CH3NH2(g)��H2O(g)������й�ʵ���������£�
������� | �¶�/K | ��ʼ���ʵ�����mol�� | ƽ�����ʵ���mol | ||||
CH3OH | NH3 | CH3NH2 | H2O | CH3NH2 | H2O | ||
I | 530 | 0.40 | 0.40 | 0 | 0 | 0.30 | |
II | 530 | 0.80 | 0.80 | 0 | 0 | ||
III | 500 | 0 | 0 | 0.20 | 0.20 | 0.16 | |
����˵����ȷ����(����)
A. ����Ӧ��ƽ�ⳣ��K(��)��K(��)<K(��)
B. �ﵽƽ��ʱ����ϵ��c(CH3OH)��ϵ��2c(CH3OH����)>c(CH3OH����)
D. 530Kʱ������ʼ���������г���CH3OH 0.10 mol��NH3 0.15 mol��CH3NH2 0.10 mol��H2O 0.10 mol����Ӧ�����淴Ӧ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������γɶ��ֺ����ᡣ
��1��һԪ��ǿ������ᣨH3PO2����һ�־�ϸ������Ʒ����10 mL H3PO2��Һ�м���10 mL�����ʵ���Ũ�ȵ�NaOH��Һ�����õ���Һ��ֻ��H2PO2-��OH-���������ӡ�
�� д��H3PO2��Һ������NaOH ��Һ��Ӧ���γɵ����εĻ�ѧʽ��_______����������Һ�и�����Ũ���ɴ�С��˳��Ϊ____________��
�� ��25��ʱ��K (H3PO2) = 1��10-2����0.01 mol �� L-1��H3PO2��Һ��pH =________��
��2�������ᣨH3PO3���Ƕ�Ԫ��ǿ�ᣬ25��ʱ������ĵ��볣��ΪK1= 3.7��10-2��K2=2.6��10-7��
�Դӵ���ƽ���ƶ��ĽǶȽ���K1��K2���ݵIJ���______________��
��3�� 25 ��ʱ��HF�ĵ��볣��ΪK = 3.6��10-4�� H3PO4�ĵ��볣��ΪK1=7.5��10-3��K2=6.2��10-8��K3��4.4��10-13������NaF��Һ��H3PO4��Һ��Ӧ�����ӷ���ʽΪ______��
��4����ͬ�¶��£������ʵ���Ũ�ȵ����������ĺ������С�c(H+)�ɴ�С��˳��Ϊ______________________________________________________������ķ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25��ʱ��������ˮϡ��1mol/L�Ĵ�����Һ��0.01mol/L������Һ��ϡ�ͣ����и�����ʼ�ձ����������Ƶ���( )
A. c(H+)/c(CH3COOH) B. c(CH3COOH)/c(H+)
C. n(CH3COOH)/c(CH3COO-) D. c(CH3COO-)c(H+)/c(CH3COOH)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������п���Ʊ���������п���ɱ��ͣ�ѡ���Ժã��乤����������:

(1)��������Ҫ�ɷֵĻ�ѧʽΪ___________��
(2)��ȡҺ�к�����Pb2+��Cu2+���ؽ������ӣ��ɼ����Լ����ȥ���Լ���Ϊ___________����ʵ�ʲ��������м�����Զ���������������ܵ�ԭ����___________��
(3)���ˢ��õ�Zn(NH3)4CO3��Һ����ˮ�������ȷ���������ʽ [ZnCO3��2Zn(OH)2��H2O]�������䷴Ӧ��ѧ����ʽΪ___________��
(4)���������л��в��ְ����ݳ������õ绯ѧ����������������NH3�ĺ�����ԭ����ͼ��ʾ�������ĵ缫��ӦΪ___________�����������������ݳ�����16.8L (��״��)���봫��������һ����Ҫͨ���״����O2�����Ϊ___________��

(5)�������ʱ����Һ�в��ఱ������С��0.2mol/L�������ఱŨ�ȹ��ͣ�ˮ�������������հ�ˮ�а�Ũ�Ƚ��ͣ�������ѭ��ʹ�ã������ఱŨ�ȹ��ߣ��ᵼ��___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪһ�������²��ö���Ե缫�Ĵ����س��װ�ã����������л������֪����װ�õĵ���Ч��![]() ��100%������˵������ȷ����
��100%������˵������ȷ����
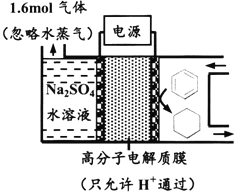
A. ���ö�缫�����˽Ӵ�������ɽ��͵��������ʧ
B. ������ͨ��C-H���Ķ���ʵ����Ĵ���
C. ����Ŀ�����ĵ缫��ӦʽΪC6H6+6e-+6H+===C6H12
D. ��![]() =75%����μӷ�Ӧ�ı�Ϊ0.8mol
=75%����μӷ�Ӧ�ı�Ϊ0.8mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�ij�ݻ��̶����ܱ������ɿ��ƶ��Ļ�������A��B���ң��ֱ���A��B���ҳ���H2��O2�Ļ�������1 mol��������ʱ������λ����ͼ��ʾ��
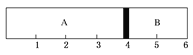
(1)A�һ����������ʵ���Ϊ________����������Ϊ________��
(2)ʵ����A�һ�����������Ϊ34 g����û��������ܶ���ͬ��ͬѹ�����º����ܶȵ�________��������A��H2��O2�Ļ�������ȼ�������ָ�ԭ�¶Ⱥ����ջ���ͣ����λ����________�̶ȣ�����������ѹǿ�뷴Ӧǰ����ѹǿ֮��Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������ǵڶ�������Ӷ�����ء�һ�������̿�(��Ҫ�ɷ�ΪMnO2�������� Fe2O3��FeO��A12O3��SiO2������)Ϊԭ���Ʊ�����﮵���������ͼ��ʾ��

(1)�ܽ�������Ϊ���SO2�����ʿɲ�ȡ�Ĵ�ʩ��_________(�����)
a.���Ͻ��裬ʹSO2�����̿�ֽӴ�
b.����ͨ��SO2������
c.�������̿Ľ�����
d.��Сͨ��SO2������
(2)��֪�������£�Ksp[A1(OH)3]=1��10-33��Ksp[Fe(OH)3]=l��10-39�� pH=7.1 ʱ Mn(OH)2��ʼ��������������ʱ(����)��ȥMnSO4Һ�е�Fe3+��Al3+(ʹ��Ũ��С��1�� l0-6mol /L)���������ҺpH��ΧΪ_______��
(3)����������K2S2O8��Һ�����»��һ�ܣ������õ����ζ�������(MnO2)����д��������Ӧ�����ӷ���ʽ___________��
(4)��MnO2�� Li2CO3��4��1�����ʵ��������ϣ���Ͻ��裬Ȼ��������600��750�棬��ȡ��ƷLiMn2O4��д���÷�Ӧ�Ļ�ѧ����ʽ _____________ ��
(5)����﮿ɳ���ص��ܷ�ӦΪ��Li1-xMn2O4+LixC![]() LiMn2O4+C(0��x��1)
LiMn2O4+C(0��x��1)

�ٳ��ʱ����ص�������ӦʽΪ_________������ʱת��lmole-����ʯī�缫������______g��
�ڷϾ�����﮵�ؿ��ܲ����е���ﮣ���ⲻ���ױ�ը���Ż�Ϊ�˰�ȫ���Բ�����Ҫ����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��5���л���ѧ����]
Prolitane��һ�ֿ�����ҩ��Է�����AΪԭ�ϵĺϳ�·�����£�

��ش��������⣺
(1)D�Ļ�ѧ����Ϊ___________��D��E�ķ�Ӧ����Ϊ___________��
(2)G�Ĺ���������Ϊ___________��
(3)B�Ľṹ��ʽΪ______________________��
(4)F��G�Ļ�ѧ����ʽΪ______________________��
(5)X��D��ͬϵ������ӱ�D������һ��̼ԭ�ӣ����ܷ���������Ӧ���������������X����___________��(���������칹)�������˴Ź���������ʾΪ5��壬��������Ϊ3�U2�U2�U2�U1��д�����ϸ�Ҫ�������һ��ͬ���칹��Ľṹ��ʽ��______________________��
(6)���� Prolitane�ĺϳ�·�ߣ����һ���ɱ����Ҵ�Ϊԭ���Ʊ������������ĺϳ�·��(�������Լ����ܼ���ѡ)��____________________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com