
����Ŀ�������£�ij�ݻ��̶����ܱ������ɿ��ƶ��Ļ�������A��B���ң��ֱ���A��B���ҳ���H2��O2�Ļ�������1 mol��������ʱ������λ����ͼ��ʾ��
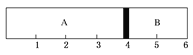
(1)A�һ����������ʵ���Ϊ________����������Ϊ________��
(2)ʵ����A�һ�����������Ϊ34 g����û��������ܶ���ͬ��ͬѹ�����º����ܶȵ�________��������A��H2��O2�Ļ�������ȼ�������ָ�ԭ�¶Ⱥ����ջ���ͣ����λ����________�̶ȣ�����������ѹǿ�뷴Ӧǰ����ѹǿ֮��Ϊ________��
���𰸡�2mol 44.8L 4.25 2 1��2
��������
(1)ͬ��ͬѹ�£���������ʵ���֮�ȵ���������֮�ȣ�����n=![]() �������������
�������������
(2)����A���л�������ƽ��Ħ��������ͬ��ͬѹ��������ܶ�֮�ȵ�����Ħ������֮�ȣ������������������ʵ����з��̼����������������ʵ��������ݷ���ʽ���㷴Ӧ��ʣ���������ʵ������ָ�ԭ�¶Ⱥ�����������ѹǿ��ȣ����֮�ȵ��������ʵ���֮�ȣ�����ȷ������ͣ����λ�ã�B���п������ʵ������䡢�¶Ȳ��䣬��Ӧǰ��ѹǿ֮���뷴Ӧǰ������ɷ��ȡ�
(1)A��B����ѹǿ���¶���ͬ����������ʵ���֮�ȵ���������֮�ȣ���A�����������ʵ���Ϊ1mol��![]() =2mol�������ڱ�״�������ΪV=n��Vm=2mol��22.4L/mol=44.8L��
=2mol�������ڱ�״�������ΪV=n��Vm=2mol��22.4L/mol=44.8L��
(2)A���л�������ƽ��Ħ������ΪM=![]() =17g/mol��ͬ��ͬѹ��������ܶ�֮�ȵ�����Ħ������֮�ȣ����Ըû��������ܶ���ͬ��ͬѹ�����º����ܶȵ�D=
=17g/mol��ͬ��ͬѹ��������ܶ�֮�ȵ�����Ħ������֮�ȣ����Ըû��������ܶ���ͬ��ͬѹ�����º����ܶȵ�D=![]() =4.25����
=4.25����
��A�����������ʵ���Ϊxmol���������ʵ���Ϊymol����x+y=2��2x+32y=34�����x=1��y=1�����ݷ�Ӧ����ʽ2H2+O2![]() 2H2O�ж��߷�Ӧ�����ʵ�����ϵ��֪O2��������Ӧ��ʣ��O2�����ʵ�����0.5mol���ָ�ԭ�¶Ⱥ�����������ѹǿ��ȣ����֮�ȵ��������ʵ���֮�ȣ�����A��B���ҵ����֮��Ϊ0.5mol��1mol=1��2�������ͣ����2�̶ȴ���
2H2O�ж��߷�Ӧ�����ʵ�����ϵ��֪O2��������Ӧ��ʣ��O2�����ʵ�����0.5mol���ָ�ԭ�¶Ⱥ�����������ѹǿ��ȣ����֮�ȵ��������ʵ���֮�ȣ�����A��B���ҵ����֮��Ϊ0.5mol��1mol=1��2�������ͣ����2�̶ȴ���
A���п������ʵ������䡢�¶Ȳ��䣬��Ӧǰ��ѹǿ֮���뷴Ӧǰ������ɷ��ȣ�������������ѹǿ�뷴Ӧǰ����ѹǿ֮��Ϊ2��4=1��2��


 ͨ��ѧ��Ĭд����ϵ�д�
ͨ��ѧ��Ĭд����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧͨ�����������Ʊ�������ͭ��

��֪CuCl������ˮ��ϡ���Cu2O+2H+==Cu2++Cu+H2O
����˵������ȷ����
A. �����SO2����Na2SO3�滻
B. �������Ϊ��ֹCuCl������������SO2ˮ��Һϴ��
C. ����ܷ�����Ӧ�����ӷ���ʽΪ2CuCl+2OH-=Cu2O+2Cl-+H2O
D. ���Cu2O�����л���CuCl��CuO���ʣ�������ϡ������Cu2O������ַ�Ӧ�����ݷ�Ӧǰ������������ɼ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£��ڹ̶��ݻ����ܱ������У����淴Ӧ�� mA(��)��nB(��) ![]() pC(��)+qD(��)����m��n��p��qΪ����������ʱ������״̬������ϵ��ѹǿ���ٷ����仯�� ����ϵ���ܶȲ��ٷ����仯�� �۸���ֵ����ʵ���Ũ�Ȳ��ٸı䣬 �ܸ���ֵ������������ٸı䣬�ݷ�Ӧ����vA��vB��vC��vD=m��n��p��q�����У���˵����Ӧ�Ѵﵽƽ�����
pC(��)+qD(��)����m��n��p��qΪ����������ʱ������״̬������ϵ��ѹǿ���ٷ����仯�� ����ϵ���ܶȲ��ٷ����仯�� �۸���ֵ����ʵ���Ũ�Ȳ��ٸı䣬 �ܸ���ֵ������������ٸı䣬�ݷ�Ӧ����vA��vB��vC��vD=m��n��p��q�����У���˵����Ӧ�Ѵﵽƽ�����
A. �ۢ� B. �ڢۢ� C. �٢ڢۢ� D. �٢ڢۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ���Ϊ��߷��w���������Դ���������ʹ���������������õ���Ҫ�о�������ش��������⣺
��.������A(H3BNH3)��һ��DZ�ڵĴ�����ϣ�������Ԫ��״����(HB=NH)3ͨ���� �·�Ӧ�Ƶ�:3CH4+2 (HB=NH) 3+6H2O=3CO2+6H3BNH3
(1)��̬Bԭ�ӵļ۵����Ų�ʽΪ___________��B��C�� N�� O��һ�������ɴ�С��˳��Ϊ_________��CH4��H2O��CO2�ļ��ǰ����ɴ�С��˳������Ϊ___________��
(2)��(HB=NH)3����Ϊ�ȵ�������л�����Ϊ___________(�����ʽ)��
��.�����İ�ȫ���������������Ӧ�õĹؼ���
(1)ӡ�����³�Ƚ���ѧ������ĵ�Datta��Pati���˽���ADF������һ���� �ͻ�ϩ�ഢ�����(C16S8)������峣������۽Ƕ�֤�����ֲ��ϵķ��ӳ�ƽ��ṹ(��ͼ)��ÿ���ӻ�ƽ������������������10��H2���ӡ�

��C16S8������Cԭ�Ӻ�Sԭ�ӵ��ӻ�������ͷֱ�Ϊ___________��
����ؼ������������ʾ��
��ѧ�� | C-S | C=S | C16S8��̼��� |
����/pm | 181 | 155 | 176 |
�ӱ������ݿ�����C16S8��̼�����������C��S����C=S��֮�䣬ԭ�����______________________��
��C16S8��H2�������������___________��
(2)�д���ܵ�ͭ�Ͻ�������������ܶѻ��ṹ��������Cuԭ��λ�����ģ�Ag ԭ��λ�ڶ��㣬��ԭ�ӿɽ�����Cuԭ����Agԭ�ӹ��ɵ��������϶�С��þ��崢���ľ����ṹ��CaF2(��ͼ)���ƣ��þ��崢���Ļ�ѧʽΪ___________��


(3)MgH2�ǽ����⻯�ﴢ����ϣ��侧������ͼ��ʾ���þ�����ܶ�Ϊagcm-3���������Ϊ___________cm3(�ú�a��NA�Ĵ���ʽ��ʾ��NA��ʾ�����ӵ�������ֵ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Կ��淴Ӧ4NH3��g��+ 5O2��g��![]() 4NO��g��+ 6H2O��g��������������ȷ����
4NO��g��+ 6H2O��g��������������ȷ����
A. �ﵽ��ѧƽ��ʱ��4������O2��= 5������NO��
B. ����λʱ��������x mol NO��ͬʱ������x mol NH3 ����Ӧ�ﵽƽ��״̬
C. �ﵽ��ѧƽ��ʱ�����������������������Ӧ���ʼ��٣��淴Ӧ��������
D. ��ѧ��Ӧ���ʹ�ϵ�ǣ�2������NH3��= 3������H2O��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڿ��淴ӦA(g)��2B(g)![]() 2C(g)(����Ӧ����)������ͼ����ȷ����
2C(g)(����Ӧ����)������ͼ����ȷ����
A. 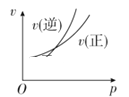 B.
B.  C.
C. 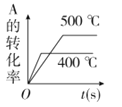 D.
D. 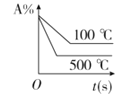
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��298Kʱ����0.1000mol/L NaOH��Һ�ζ�20.00mLͬŨ�ȵļ�����Һ��������ҺpH��NaOH��Һ����Ĺ�ϵ��ͼ��ʾ(��֪��HCOOH��Һ��Ka=l.0��10-4.0)

�����й�������ȷ����
A. �õζ�����Ӧ��ѡ�������Ϊָʾ��
B. ͼ��a��b�����ĵ���̶ȣ�b>a
C. ������10.00mL NaOH��Һʱ����Һ�У�c(HCOO)>c(H+)>c(Na+)>c(OH)
D. ������20.00mL NaOH��Һʱ����ҺpH>8.0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A. ��֪�����ۻ���Ϊ6.0kJ��mol��1�������������Ϊ20kJmol��1������ÿĦ��������2mol��������ۻ�����ȫ���ڴ��Ʊ�������������ֻ���ƻ�����15%�����
B. ��֪һ���¶��£�������Һ�����ʵ���Ũ��Ϊc�������Ϊa��Ka=(ca)2/c(1��a)������ˮϡ�ͣ�����CH3COOH![]() CH3COO��+H+�����ƶ���a����Ka����
CH3COO��+H+�����ƶ���a����Ka����
C. ����ı�ȼ����Ϊ��890.3kJ��mol��1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4(g)+2O2(g)=CO2(g)+2H2O(l) ��H=��890.3kJ��mol��1
D. 500����30MPa�£���0.5molN2��1.5molH2�����ܱյ������г�ַ�Ӧ����NH3(g)������19.3kJ�����Ȼ�ѧ����ʽΪ��N2(g)+3H2(g)![]() 2NH3(g) ��H=��38.6kJ��mol��1
2NH3(g) ��H=��38.6kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2019 ���ǡ����ʻ�ѧԪ�����ڱ��ꡱ�� 1869 ���Ž��з�ѵ�ʱ��֪��Ԫ�ظ�����������ѧ���ʽ������У�ȷԤ���˼ס�������δ֪Ԫ�ص�λ�ã���Ԥ���˶��ߵ����ԭ������������ԭʼ��¼���¡�����˵���д������
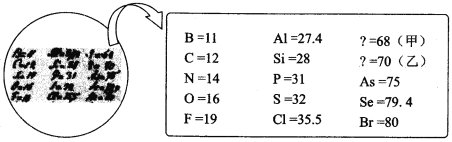
A. ��λ������Ԫ�����ڱ��������ڵڢ�A ��B. ԭ�Ӱ뾶�Ƚϣ��ף��ң� Si
C. �ҵļ���̬�⻯����ȶ���ǿ��CH4D. �Ʋ��ҵĵ��ʿ��������뵼�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com