
【题目】某同学通过如下流程制备氧化亚铜:

已知CuCl难溶于水和稀硫酸:Cu2O+2H+==Cu2++Cu+H2O
下列说法不正确的是
A. 步骤②SO2可用Na2SO3替换
B. 步骤③中为防止CuCl被氧化,可用SO2水溶液洗涤
C. 步骤④发生反应的离子方程式为2CuCl+2OH-=Cu2O+2Cl-+H2O
D. 如果Cu2O试样中混有CuCl和CuO杂质,用足量稀硫酸与Cu2O试样充分反应,根据反应前、后固体质量可计算试样纯度
【答案】D
【解析】
碱式碳酸铜溶于过量的稀盐酸,得到CuCl2溶液,向此溶液中通入SO2,利用SO2的还原性将Cu2+还原生成CuCl白色沉淀,将过滤后的CuCl与NaOH溶液混合加热得砖红色沉淀Cu2O,据此解答。
A.Na2SO3有还原性,则步骤②还原Cu2+,可用Na2SO3替换SO2,A正确;
B.CuCl易被空气中的氧气氧化,用还原性的SO2的水溶液洗涤,可达防氧化的目的,B正确;
C.CuCl与NaOH溶液混合加热得砖红色沉淀Cu2O,根据电子守恒、电荷守恒及原子守恒可知发生反应的离子方程式为2CuCl+2OH-![]() Cu2O+2Cl-+H2O,C正确;
Cu2O+2Cl-+H2O,C正确;
D.CuCl也不溶于水和稀硫酸,Cu2O溶于稀硫酸生成不溶于的Cu,则过滤后所得滤渣为Cu和CuCl的混合物,无法计算出样品中Cu2O的质量,即无法计算样品纯度,D错误;
答案选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某电路板生产企业的水质情况及国家允许排放的污水标准如下表所示。为研究废水中Cu2+处理的最佳pH,取5份等量的废水,分别用30%的NaOH溶液调节pH至8.5、9、9.5、10、11,静置后,分析上层清液中铜元素的含量,实验结果如下图所示。

查阅资料,平衡I:Cu(OH)2 + 4NH3 ![]() [Cu(NH3)4]2+ + 2OH-;
[Cu(NH3)4]2+ + 2OH-;
平衡II:Cu(OH)2 + 2OH- ![]() [Cu(OH-)4]2-
[Cu(OH-)4]2-
项目 | 废水水质 | 排放标准 |
pH | 1.0 | 6~9 |
Cu2+/ mg·L-1 | 72 | ≤0.5 |
NH4+/ mg·L-1 | 2632 | ≤15 |
下列说法不正确的是
A. 废水中Cu2+处理的最佳pH约为9
B. b~c段:随pH升高,Cu(OH)2的量增加,平衡I正向移动,铜元素含量上升
C. c~d段:随pH升高,c(OH-)增加,平衡I逆向移动,铜元素含量下降
D. d点以后,随c(OH-)增加,铜元素含量可能上升
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图示与对应的叙述符合的是
A. 如图可知实线、虚线分别表示某可逆反应未使用催化剂和使用催化剂的正、逆反应速率随时间的变化

B. 如图可知,反应C(金刚石,s) ══ C(石墨,s)的焓变ΔH ══ ΔH1-ΔH2

C. 如图可知表示除去氧化膜的镁条放入盐酸中生成氢气速率随时间的变化,起初反应速率加快的原因可能是该反应为放热反应

D. 如图可知表示25℃时用0.1000 mol·L-1醋酸滴定40.00 mL 0.1000 mol·L-1NaOH溶液得到的滴定曲线

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲胺(CH3NH2)是合成太阳能敏化剂的原料。一定温度下,在三个体积均为2.0 L的恒容密闭容器中按不同方式投入反应物,发生反应CH3OH(g)+NH3(g) CH3NH2(g)+H2O(g),测得有关实验数据如下:
容器编号 | 温度/K | 起始物质的量(mol) | 平衡物质的量mol | ||||
CH3OH | NH3 | CH3NH2 | H2O | CH3NH2 | H2O | ||
I | 530 | 0.40 | 0.40 | 0 | 0 | 0.30 | |
II | 530 | 0.80 | 0.80 | 0 | 0 | ||
III | 500 | 0 | 0 | 0.20 | 0.20 | 0.16 | |
下列说法正确的是( )
A. 正反应的平衡常数K(Ⅰ)=K(Ⅱ)<K(Ⅲ)
B. 达到平衡时,体系中c(CH3OH)关系:2c(CH3OH,Ⅰ)>c(CH3OH,Ⅱ)
D. 530K时,若起始向容器Ⅰ中充入CH3OH 0.10 mol、NH3 0.15 mol、CH3NH2 0.10 mol、H2O 0.10 mol,则反应将向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产、生活中有广泛的应用。
(1)复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解制氢气,原理如下:
①MnFe2O4(s)===MnFe2O(4-x)(s)+x/2O2(g) ΔH1
②MnFe2O(4-x)(s)+xH2O(g)===MnFe2O4(s)+xH2(g) ΔH2
③2H2O(g)===2H2(g)+O2(g) ΔH3
则:ΔH3与ΔH1、ΔH2的关系为ΔH3=________。
(2)纳米铁是重要的储氢材料,可用下列反应制得:Fe(s)+5COFe(CO)5(g) ΔH<0。在1 L恒容密闭容器中加入足量铁粉和0.5 mol CO,在T1、T2不同温度下进行反应,测得c(CO)与温度、时间的关系如图1所示。

①T1________(填“>”或“<”)T2。
②T2温度下,上述反应的平衡常数K=________(结果不要求带单位)。
(3)高铁酸钾(K2FeO4)被人们称为“绿色化学”净水剂。高铁酸钾在酸性至弱碱性条件下不稳定。
①工业上用KClO与Fe(NO3)3溶液反应制得K2FeO4,反应的离子方程式为____________________。制备K2FeO4时,KClO饱和溶液与Fe(NO3)3饱和溶液混合的操作为________________________。
②已知K2FeO4在水解过程中铁元素形成的微粒分布分数与pH的关系如图所示。


向pH=6的溶液中加入KOH溶液,发生反应的离子方程式为____________________________________。
(4)电解法可制得K2FeO4,装置如图所示。阳极的电极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2OH++OH-△H>0,下列叙述正确的是( )
A. 向平衡体系中加入水,平衡正向移动,c (H+)增大
B. 将水加热,Kw增大,pH不变
C. 向水中加入少量硫酸氢钠固体,  增大
增大
D. 向水中加入少量NaOH固体,平衡正向移动,c(H+)降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子半径依次增大,X是短周期元素中原子半径最小的,Z、W同主族,且Z、W的原子序数之差与Y的原子序数相同,X、Y、Z、W的最外层电子数之和为15。下列说法正确的是( )
A. Z单质与WYZ在高温条件下反应生成W单质,说明非金属性:Z>W
B. 向无色的X2Z2Y4溶液中滴加少量酸性高锰酸钾溶液,溶液仍为无色,体现了X2Z2Y4的还原性
C. Y、Z、W的简单氢化物的稳定性依次增强
D. 由X、Y两种元素形成的所冇化合物中所含化学键的类型完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷能形成多种含氧酸。
(1)一元中强酸次磷酸(H3PO2)是一种精细化工产品,向10 mL H3PO2溶液中加入10 mL等物质的量浓度的NaOH溶液后,所得的溶液中只有H2PO2-、OH-两种阴离子。
① 写出H3PO2溶液与足量NaOH 溶液反应后形成的正盐的化学式:_______,该正盐溶液中各离子浓度由大到小的顺序为____________。
② 若25℃时,K (H3PO2) = 1×10-2,则0.01 mol · L-1的H3PO2溶液的pH =________。
(2)亚磷酸(H3PO3)是二元中强酸,25℃时亚磷酸的电离常数为K1= 3.7×10-2、K2=2.6×10-7。
试从电离平衡移动的角度解释K1、K2数据的差异______________。
(3) 25 ℃时,HF的电离常数为K = 3.6×10-4; H3PO4的电离常数为K1=7.5×10-3,K2=6.2×10-8,K3=4.4×10-13。足量NaF溶液和H3PO4溶液反应的离子方程式为______。
(4)相同温度下,等物质的量浓度的上述三种磷的含氧酸中。c(H+)由大到小的顺序为______________________________________________________(用酸的分子式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两室,分别向A、B两室充入H2、O2的混合气体和1 mol空气,此时活塞的位置如图所示。
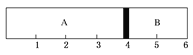
(1)A室混合气体的物质的量为________,标况下体积为________。
(2)实验测得A室混合气体的质量为34 g,则该混合气体的密度是同温同压条件下氦气密度的________倍。若将A室H2、O2的混合气体点燃引爆,恢复原温度后,最终活塞停留的位置在________刻度,容器内气体压强与反应前气体压强之比为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com