
【题目】白磷与氧可发生如下反应:P4+5O2═P4O10 . 已知断裂下列化学键需要吸收的能量分别为:P﹣P:a kJmol﹣1、P﹣O:b kJmol﹣1、P=O:c kJmol﹣1、O=O:d kJmol﹣1 . 根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
A.(6a+5d﹣4c﹣12b)kJmol﹣1
B.(4c+12b﹣6a﹣5d)kJmol﹣1
C.(4c+12b﹣4a﹣5d)kJmol﹣1
D.(4a+5d﹣4c﹣12b)kJmol﹣1
科目:高中化学 来源: 题型:
【题目】用镁一次氯酸钠燃料电池作电源模拟消除工业酸性废水中的Cr2O72-的过程(将“Cr2O72-”还原为“Cr3+”),装置如图所示。下列说法中错误的是
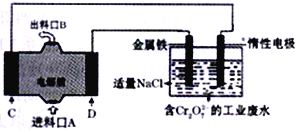
A. 金属铁电极的反应为:Fe-2e-=Fe2+
B. 装置中电子的流动路线是: C电极→惰性电极→金属铁电极→D电极
C. 装置工作过程中消耗14.4gMg,理论上可消除Cr2O72-0.1mol
D. 将Cr2O72-处理后的废水比原工业废水的pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】平昌冬奥会“北京8 分钟”主创团队用石墨烯制作了-20℃能发热4 h 的智能服饰; 用铝合金管材和碳纤维制作了高2.35m、重量仅为10kg 的熊猫木偶,向世界展现了新时代的中国形象。下列说法中,不正确的是

A. 石墨烯是能导热的金属材料 B. 铝合金是密度较低的金属材料
C. 碳纤维是耐低温的无机非金属材料 D. 新型材料种类多、用途广
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C,H,N三种元素在人体的化学成分中,质量分数共占73%左右,而这三种元素在组成岩石圈的化学成分中,质量分数不到1%。这个事实说明
A. 生物界和非生物界具有统一性
B. 生物界和非生物界具有差异性
C. 这三种元素是组成人体的主要元素
D. 生物界和非生物界的组成元素完全不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学工作者一直在积极探索影响大气质量的因素及改善措施。
(1)硫酸盐是大气中可吸入颗粒物的主要成分之一,是在含水的气溶胶液滴中通过化学反应产生的。
①气溶胶属于胶体分散系。当日光射入充满气溶胶的暗室时,可观察到_______效应。
②大气中的SO2转化为硫酸盐的过程中,以下物质能起氧化作用的是_____(填字母序号)。
a.O2 b.H2S c.NH3 d.O3
③有研究者发现特定条件下,大气中的NOx会成为氧化SO2的主要物质,于是认为,当城市大气中的可吸入颗粒物严重超标时,应采取汽车限行措施。原因是_________。
(2)燃煤烟气中含有NOx和SO2。工业上常用亚氯酸钠(NaClO2)对燃煤烟气进行脱硝和脱硫处理。
已知:酸性条件下,ClO2-会转化成ClO2和Cl-。ClO2是黄绿色、易溶于水的气体,具有强氧化性,可氧化NOx或SO2。
I.在实验室模拟脱硝过程:调节NaClO2吸收液的pH为5,向其中通入含NO的模拟烟气。
①测得脱硝反应后,溶液中的阴离子为NO3-和Cl-,则脱硝反应的离子方程式为_______。
②测得脱硝效率(即NO的吸收率)随温度变化的曲线如下图所示。结合已知信息分析,温度大于50℃时,随温度升高脱硝效率下降的原因是____________。

Ⅱ.在实验室模拟同时脱硝、脱硫过程:调节NaClO2吸收液的pH为5,向其中通入含SO2和NO(体积比2:1)的模拟烟气。
③测得脱硝、脱硫反应后,溶液中的阴离子为NO3-、SO42-和Cl-,其中c(SO42-)=amol/L,c(Cl-)=bmol/L,已知脱硫效率为100%,计算脱硝效率为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素能够形成多种化合物。请回答下列问题:
(1)联氨(N2H4)在空气中迅速完全燃烧生成N2,同时放大量热,可作火箭的燃料。
已知:H2(g)+1/2O2(g)==H2O(g) △H1=-241.8kJ/mol
N2(g)+2H2(g)=N2H4(l) △H2=+50.6kJ/mol
H2O(g)= H2O(l) △H3=-44kJ/mol
则N2H4(l)在空气燃烧生成N2和气态水的热化学方程式为________________________。
(2)汽车尾气中的氮氧化物是形成酸雨的气体之一,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如下图。写出该脱硝原理总反应的化学方程式:___________________________。

(3)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH= a kJ/mol
N2(g)+CO2(g) ΔH= a kJ/mol
在T1℃时,反应进行到不同时间测得各物质的量浓度如下:

根据图表数据分析T1℃时:
①该反应在0-20min的平均反应速率v(NO)= _________ ;
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是 _________(填字母)。
A.通入一定量的CO2
B.加入合适的催化剂
C.适当缩小容器的体积
D.通入一定量的NO
E.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:1:1,则a _____0(填“>”或“<”)。
(4)电解法合成氨因其原料转化率大幅度提高,有望代替传统的工业合成氨工艺。下图是一种电解法合成氨的装置图。则b电极上的电极反应式为__________________________。

(5)AgCl能溶于氨水,发生反应AgCl(s)+2NH3(aq) ![]() Ag(NH3)2+(aq) +Cl-(aq),其平衡常数K=1.936×10-3。现用1L某浓度氨水(溶质视为NH3)完全溶解0.1molAgCl,所需氨水浓度至少为________。(写出表达式即可)
Ag(NH3)2+(aq) +Cl-(aq),其平衡常数K=1.936×10-3。现用1L某浓度氨水(溶质视为NH3)完全溶解0.1molAgCl,所需氨水浓度至少为________。(写出表达式即可)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com