
| 时间(s)n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
分析 (1)20s生成二氧化氮0.24mol,则消耗N2O4为0.24mol×$\frac{1}{2}$=0.12mol,故a=0.4-0.12=0.28mol,再根据v=$\frac{△c}{△t}$计算v(N2O4);
(2)80s到达平衡,平衡时二氧化氮为0.6mol,则平衡时N2O4为0.4mol-0.6mol×$\frac{1}{2}$=0.1mol,再根据K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$计算平衡常数;
(3)平衡常数只受温度影响,正反应为吸热反应,升高温度平衡正向移动,平衡常数增大.
解答 解:(1)20s生成二氧化氮0.24mol,则消耗N2O4为0.24mol×$\frac{1}{2}$=0.12mol,故a=0.4-0.12=0.28mol,则20s~40s内v(N2O4)=$\frac{\frac{0.28mol-0.20mol}{2L}}{40s-20s}$=0.0020 mol•L-1•s-1,
故答案为:0.0020;
(2)80s到达平衡,平衡时二氧化氮为0.6mol,则平衡时N2O4为0.4mol-0.6mol×$\frac{1}{2}$=0.1mol,故平衡常数K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$=$\frac{(\frac{0.6mol}{2L})^{2}}{\frac{0.1mol}{2L}}$=1.8mol•L-1,
故答案为:1.8mol•L-1;
(3)平衡常数只受温度影响,正反应为吸热反应,升高温度平衡正向移动,平衡常数增大,故选:D.
点评 本题考查化学平衡计算、反应速率计算、平衡常数计算及影响因素,比较基础,注意平衡常数只受温度影响.


科目:高中化学 来源: 题型:选择题
| A. | 一氧化碳的转化率提高,水蒸气的转化率降低 | |
| B. | 反应物的转化率都提高 | |
| C. | 平衡向正反应方向移动,达到新的平衡时二氧化碳的体积分数增大 | |
| D. | 平衡向正反应方向移动,二氧化碳的物质的量将大于1 mol但小于2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
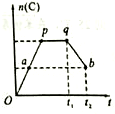 在一定条件,可逆反应:mA+nB?pC达到平衡状态.
在一定条件,可逆反应:mA+nB?pC达到平衡状态.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核外电子排布--元素在周期表中的位置 | |
| B. | 弱电解质的相对强弱--电离常数的大小 | |
| C. | 分子间作用力的大小--分子稳定性的高低 | |
| D. | 物质内部储存的能量--化学反应的热效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
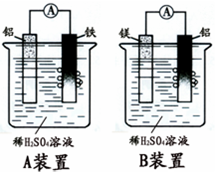 有甲.乙两位学生分别利用如图A,B装置的原电池反应检测金属的活动性顺序,
有甲.乙两位学生分别利用如图A,B装置的原电池反应检测金属的活动性顺序,查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应过程中的氧化产物均为SO3 | |
| B. | a点时消耗NaHSO3的物质的量为1.0 mol | |
| C. | 0~b间的反应可用如下离子方程式表示:3HSO3-+IO3-=3SO42-+I-+3H+ | |
| D. | 当溶液中I?与I2的物质的量之比为1:1时,加入的NaIO3为1.2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 序号 | ① | ② | ③ | ④ | ⑤ |
| 溶液 | NaCl | CH3COONH4 | NaClO | NaHCO3 | Na2CO3 |
| pH | 7.0 | 7.0 | 10.3 | 8.3 | 11.6 |
| A. | 酸性的相对强弱:HClO>HCO3- | |
| B. | 由水电离产生的c(H+):①=② | |
| C. | 溶液③④中酸根离子浓度:c(ClO-)>c(HCO3-) | |
| D. | 在④⑤溶液等体积混合后的溶液中:c(HCO3-)+c(CO32-)+c(H2CO3)=0.1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在熔融状态或溶于水能导电的物质叫电解质 | |
| B. | 电解质在通电时发生电离 | |
| C. | 熔融的KOH导电,所以KOH是电解质 | |
| D. | NaCl晶体不导电,所以NaCl不是电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com