某化学兴趣小组为探究SO
2的性质,按图所示装置进行实验.

请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是
蒸馏烧瓶
蒸馏烧瓶
.
(2)实验过程中,装置B中产生的现象是
溶液颜色由紫色逐渐褪去
溶液颜色由紫色逐渐褪去
,这个现象说明SO
2具有的性质是
还原性
还原性
.
(3)装置C中Na
2S溶液在空气中不易保存,时间长了会变浑浊,原因是:(用离子方程式)
2S2-+O2+2H2O=2S↓+4OH-
2S2-+O2+2H2O=2S↓+4OH-
.
(4)装置D的目的是探究SO
2与品红作用的可逆性,请写出实验操作及现象
品红溶液褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,溶液恢复为红色
品红溶液褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,溶液恢复为红色
.
(5)如果把分液漏斗中的中的浓H
2SO
4换作浓HNO
3,对此实验是否有影响
是
是
(填“是”或“否”),请说明你的理由
浓硝酸可将亚硫酸钠氧化为硫酸钠,而得不到二氧化硫气体
浓硝酸可将亚硫酸钠氧化为硫酸钠,而得不到二氧化硫气体
.
(6)工业上用黄铜矿(CuFcS
2)冶炼铜,副产品中也有SO
2,冶炼铜的反应为:8CuFeS
2+21O
28Cu+4FeO+2Fe
20
3+16SO
2若CuFeS
2中Fe的化合价为+2,反应中被还原的元素是
Cu、O
Cu、O
.(填元素符号)当生成0.8mol铜时,此反应转移的电了数目是
10NA
10NA
.




 某化学兴趣小组为探究铜跟浓硫酸的反应,如图所示装置进行有关实验.
某化学兴趣小组为探究铜跟浓硫酸的反应,如图所示装置进行有关实验.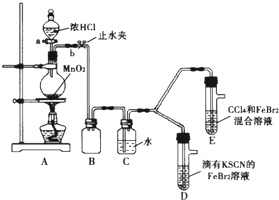 某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验: 某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验.
某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验.

