
【题目】已知反应X(g)+Y(g)![]() nZ(g) ΔH>0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。下列说法不正确的是( B )
nZ(g) ΔH>0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。下列说法不正确的是( B )

A. 反应方程式中n=1
B. 10 min时,曲线发生变化的原因是升高温度
C. 10 min时,曲线发生变化的原因是增大压强
D. 0~5 min内,用X表示的反应速率为v(X)=0.08 mol·L-1·min-1
【答案】B
【解析】
A.10min时反应物和生成物浓度瞬间同时增大,说明是增大了压强,反应物浓度逐渐减小,生成物浓度增加,平衡正向移动,则说明该反应是体积缩小的反应,即n=1,故A正确;B.根据图象数据可知,10min时反应物和生成物浓度瞬间同时增大,则说明10min时增大了压强,故B错误;C.根据图象数据可知,10min时反应物和生成物浓度瞬间同时增大,则说明10min时增大了压强,故C正确;在5min时X的物质的量为1.8mol,0~5minx的物质的量变化为2mol-1.8mol=0.2mol,则该时间段X的平均反应速率为v(X)=![]() =0.08 mol·L-1·min-1;故D正确;故选B。
=0.08 mol·L-1·min-1;故D正确;故选B。


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】实验室欲进行0.1mol/L NaOH溶液与0.1mol/LHCl溶液的反应:
(1)写出NaOH溶液与HCl溶液反应的离子方程式___。
(2)要配制0.1mol/LNaOH溶液500mL,回答下列问题:
①需要称量NaOH固体___g;
②将NaOH固体用蒸馏水溶解后,未冷却直接转移至容量瓶,将导致所配制溶液浓度___。(填“偏大”、“偏小”或“无影响”)
③定容时,加蒸馏水至离刻度线下方1-2cm时,改用___继续滴加蒸馏水,使得溶液凹液面与刻度线相切。
(3)如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:

①该浓盐酸的物质的量浓度为___mol/L。
②欲用上述浓盐酸和蒸馏水配制0.1mol/L HCl溶液500mL,需用量筒量取___mL上述浓盐酸进行配制。
③实验室用稀盐酸溶解碳酸钙时,请写出对应的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学设计如图装置:

回答下列问题:
(1)乙中铜片为________极 (填“正”或“负”),其电极反应式为__________________
(2)若丙池盛放足量的CuSO4溶液:①在丙池铁棒这极的现象是____________________。②在丙池中阳极的电极反应是_______________________________________。
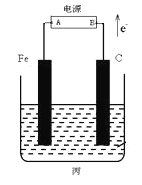
(3)若丙池中盛放滴加少量酚酞的饱和NaCl溶液1L(假设溶液体积电解前后无变化)。
①丙池通电一段时间后,___极附近溶液呈红色(填Fe或C),总反应的离子方程式:________。
②标准状况下,当丙池中有0.1mol电子发生转移时切断电源,则理论上有____ L氯气生成。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用间接电化学法可对大气污染物NO进行无害化处理,其工作原理如图所示。下列说法正确的是

A. 电极I为阴极,电极反应式为2H2O+2e一=2OH-+H2↑
B. 电解时H+由电极I向电极II迁移
C. 吸收塔中的反应为2NO+2S2O42-+2H2O=N2+4HSO3-
D. 每处理1molNO,可同时得到32gO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究Na2O2与水的反应,实验如图:(已知:H2O2 ![]() H+ + HO2-、HO2-
H+ + HO2-、HO2- ![]() H+ + O22-)下列分析不正确的是
H+ + O22-)下列分析不正确的是

A. ①、⑤中产生的气体能使带火星的木条复燃
B. ①、④中均发生了氧化还原反应和复分解反应
C. ②、⑤中KMnO4与MnO2的作用不同,产生气体的量也不同
D. 通过③能比较酸性:HCl>H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将H2S转化为可再利用的资源是能源研究领域的重要课题。
(1)H2S的转化
Ⅰ | 克劳斯法 |
|
Ⅱ | 铁盐氧化法 |
|
Ⅲ | 光分解法 |
|
① 反应Ⅰ的化学方程式是________。
② 反应Ⅱ:____+ 1 H2S ==____Fe2+ + ____S↓ + ____(将反应补充完整)。
③ 反应Ⅲ体现了H2S的稳定性弱于H2O。结合原子结构解释二者稳定性差异的原因:_______。
(2)反应Ⅲ硫的产率低,反应Ⅱ的原子利用率低。我国科研人员设想将两个反应耦合,实现由H2S高效产生S和H2,电子转移过程如图。

过程甲、乙中,氧化剂分别是______。
(3)按照设计,科研人员研究如下。
① 首先研究过程乙是否可行,装置如图。经检验,n极区产生了Fe3+,p极产生了H2。n极区产生Fe3+的可能原因:

ⅰ.Fe2+ - e- = Fe3+
ⅱ.2H2O -4e-=O2 +4H+,_______(写离子方程式)。经确认,ⅰ是产生Fe3+的原因。过程乙可行。
② 光照产生Fe3+后,向n极区注入H2S溶液,有S生成,持续产生电流,p极产生H2。研究S产生的原因,设计如下实验方案:______。 经确认,S是由Fe3+氧化H2S所得,H2S不能直接放电。过程甲可行。
(4)综上,反应Ⅱ、Ⅲ能耦合,同时能高效产生H2和S,其工作原理如图。

进一步研究发现,除了Fe3+/Fe2+ 外,I3-/I- 也能实现如图所示循环过程。结合化学用语,说明I3-/I- 能够使S源源不断产生的原因:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L密闭容器中充入4mol A气体和3mol B气体,发生下列反应:2A(g)+B(g)![]() C(g)+xD(g),5s达到平衡。达到平衡时,生成了1mol C,测定D的浓度为2mol/L。
C(g)+xD(g),5s达到平衡。达到平衡时,生成了1mol C,测定D的浓度为2mol/L。
(1)求x =____。
(2)求这段时间A的平均反应速率为_____ mol·L-1·s-1。
(3)平衡时B的浓度为______ mol·L-1。
(4)A的转化率为_________。(转化率a=![]() )
)
(5)5s达到平衡,容器内混合气体的平均相对分子质量比起始时______![]() 填“大”、“小”或“相等”,下同
填“大”、“小”或“相等”,下同![]() ,混合气体密度比起始时______。
,混合气体密度比起始时______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或现象不能用平衡移动原理解释的是
A. 卤化银沉淀的转化

B. 配制FeCl3溶液

C. 淀粉在不同条件下水解

D. 探究石灰石与稀盐酸在密闭环境下的反应

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com