
分析 A、B、D、E、G是原子序数依次增大的五种短周期元素,B与G的单质都能与H2反应生成“HX”(X代表B或G)型氢化物,则B、G处于ⅤⅡA族,都是短周期元素,则B为F、G为Cl元素;D为同周期主族元素中原子半径最大的元素,则D为Na元素;A与E同主族,A、B和E的原子最外层电子数之和为19,B为F元素,最外层含有7个电子,则A、E的最外层电子数之和为:19-7=12,则A、E最外层都含有6个电子,为ⅥA族元素,则A为O、E为S元素,据此进行解答.
解答 解:A、B、D、E、G是原子序数依次增大的五种短周期元素,B与G的单质都能与H2反应生成“HX”(X代表B或G)型氢化物,则B、G处于ⅤⅡA族,都是短周期元素,则B为F、G为Cl元素;D为同周期主族元素中原子半径最大的元素,则D为Na元素;A与E同主族,A、B和E的原子最外层电子数之和为19,B为F元素,最外层含有7个电子,则A、E的最外层电子数之和为:19-7=12,则A、E最外层都含有6个电子,为ⅥA族元素,则A为O、E为S元素,
(1)B为F元素,原子序数为9,位于周期表中第2周期 第VIIA族,
故答案为:第2周期 第VIIA族;
(2)D为Na元素,其氧化物为氧化钠和过氧化钠,二者属于离子化合物,都含有离子键,
故答案为:离子键;
(3)E为S元素,S的最高价氧化物对应水化物的浓溶液为浓硫酸,浓硫酸和木炭共热反应的化学方程式为:2H2SO4(浓)+C$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:2H2SO4(浓)+C$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(4)D为Na元素,Na的最高价氧化物对应水化物的溶液为NaOH,G的单质为氯气,氯气与氢氧化钠溶液反应的离子方程式为:Cl2+2OH-═ClO-+Cl-+H2O,
故答案为:Cl2+2OH-═ClO-+Cl-+H2O;
(5)F和Cl都位于VIIA族,其原子最外层电子数均为7,均可与氢原子共用一对电子形成共价键,属于B、G单质都能与H2 反应生成HX 型氢化物,
故答案为:氟和氯同在VIIA族,其原子最外层电子数均为7,均可与氢原子共用一对电子形成共价键.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度中等,推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题
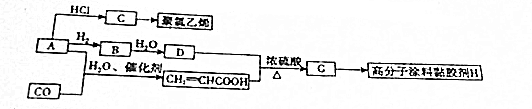
 ,A→C的反应类型:加成反应.
,A→C的反应类型:加成反应.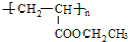 ,写出D的同分异构体的结构简式:CH3OCH3.
,写出D的同分异构体的结构简式:CH3OCH3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
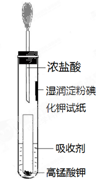 氯气是氯碱工业的主要产品之一,它是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:
氯气是氯碱工业的主要产品之一,它是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
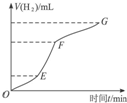 某化学课外小组的同学用Mg等与稀硫酸反应制H2,根据反应进行的情况,同学们得出了反应时间与产生H2的体积关系,并做出了如图.请回答:
某化学课外小组的同学用Mg等与稀硫酸反应制H2,根据反应进行的情况,同学们得出了反应时间与产生H2的体积关系,并做出了如图.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将饱和氯化铁溶液滴入氢氧化钠溶液中即可 | |
| B. | 将饱和氯化铁溶液滴入热水中,生成棕黄色液体即可 | |
| C. | 将饱和氯化铁溶液滴入沸水中,并继续煮沸至生成红褐色液体即可 | |
| D. | 将饱和氯化铁溶液滴入沸水中,并继续煮沸至生成红褐色沉淀即可 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (SCN)2+2Br-→Br2+2SCN- | |
| B. | (SCN)2+H2S→2H++2SCN-+S↓ | |
| C. | 4H++2SCN-+MnO2 $\stackrel{△}{→}$Mn2++(SCN)2↑+2H2O | |
| D. | (SCN)2+2I-→2SCN-+I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
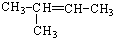 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com