
【题目】Co(H2PO2)2广泛用于化学镀钴,以金属Co和NaH2PO2为原料,采用四室电渗析槽电解法制备,原理如图。下列叙述正确的是

A. b为阳离子交换膜
B. 通电后原料室的H2PO2向产品室迁移,阴极区溶液pH增大
C. 石墨电极反应为4OH4e![]() O2↑+2H2O
O2↑+2H2O
D. 当产生1 mol Co(H2PO2)2时,产生标准状况下气体11.2 L
【答案】B
【解析】
由金属Co生成Co(H2PO2)2可知,Co电极为阳极,Co放电生成Co2+,Co2+离子阳离子交换膜进入产品室,原料室的H2PO3-穿过阴膜扩散至产品室,二者反应生成Co(H2PO2)2;石墨电极为阴极,阴极上水电离出的H+放电,使阴极区OH—浓度增大,原料室中Na+通过阳离子交换膜进入阴极区,使得阴极区氢氧化钠溶液浓度增大。
A项、原料室的H2PO3-穿过阴膜扩散至产品室,b为阴离子交换膜,故A错误;
B项、通电后原料室的H2PO2向产品室迁移,阴极区,阴极上水电离出的H+放电,使阴极区OH—浓度增大,溶液pH增大,故B正确;
C项、石墨电极为阴极,阴极上水电离出的H+放电,电极反应式为2H2O+2e=H2↑+2 OH,故C错误;
D项、当产生1 mol Co(H2PO2)2时,阳极上1 mol Co放电,失去2mol电子,则阴极上水放电有1 mol H2生成,标准状况下H2体积为22.4L,故D错误。
故选B。


科目:高中化学 来源: 题型:
【题目】实验室用乙酸和正丁醇制备乙酸正丁酯。有关物质的相关数据如下表:
化合物 | 相对分子质量 | 密度 /g·cm-3 | 沸点 /℃ | 溶解度 /100g水 |
正丁醇 | 74 | 0.80 | 118.0 | 9 |
冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |

操作如下:
①在50mL三颈烧瓶中,加入18.5mL正丁醇和13.4mL冰醋酸,3-4滴浓硫酸,投入沸石。安装分水器![]() 作用:实验过程中不断分离除去反应生成的水
作用:实验过程中不断分离除去反应生成的水![]() 、温度计及回流冷凝管。
、温度计及回流冷凝管。
②将分水器分出的酯层和反应液一起倒入分液漏斗中,水洗,10%Na2CO3溶液洗涤,再水洗,最后转移至锥形瓶,干燥。
③将干燥后的乙酸正丁酯滤入烧瓶中,常压蒸馏,收集馏分,得到15.1g乙酸正丁酯。
请回答有关问题:
(1)冷水应该从冷凝管___(填“a”或“b”)端管口通入;
(2)反应中浓硫酸的作用是___;
(3)步骤②中用10%Na2CO3溶液洗涤有机层,该操作的目的是___;
(4)进行分液操作时,使用的漏斗是___(填选项);

(5)步骤③在进行蒸馏操作时,若从118℃开始收集馏分,产率偏__(填“高”或“低”),原因__;
(6)该实验过程中,生成乙酸正丁酯的产率是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含镍(Ni)质量分数约20%废料,主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物。由该废料制备纯度较高的氢氧化镍,工艺流程如下:
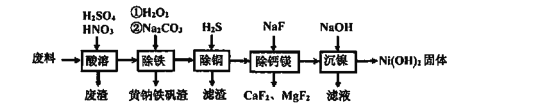
回答下列问题:
(1)合金中的镍难溶于稀硫酸,“酸溶”时除了加入稀硫酸,还要边搅拌边缓慢加入稀硝酸,反应有N2生成。写出金属镍溶解的化学方程式______________________
(2)“除铁”时H2O2的作用是________________,为了证明添加的H2O2已足量,应选择的试剂是_______________ (填序号:“①铁氰化钾K3[Fe(CN)6]”或“②硫氰化钾KSCN”)溶液.黄钠铁矾[NaxFey(SO4)m(OH)n]具有沉淀颗粒大、沉淀速率快、容易过滤等特点,则x:y:m:n=1:____:2:6
(3)“除铜”时,反应的离子方程式为________________
(4)已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF“除钙镁”后,所得滤液中![]() ________________(保留1位小数)。已知除杂过程在陶瓷容器中进行,NaF的实际用量不宜过大的原因是__________
________________(保留1位小数)。已知除杂过程在陶瓷容器中进行,NaF的实际用量不宜过大的原因是__________
(5)100kg废料经上述工艺制得Ni(OH)2固体的质量为31kg,则镍回收率为______________(保留1位小数)
(6)镍氢电池已成为混合动力汽车的主要电池类型,其工作原理如下:M+Ni(OH)2![]() MH+NiOOH(式中M为储氢合金)。写出电池充电过程中阳极的电极反应式___________
MH+NiOOH(式中M为储氢合金)。写出电池充电过程中阳极的电极反应式___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关反应速率的说法正确的是:
A. 用铁片和稀硫酸反应制氢气时,改用98%的硫酸可以加快反应速率
B. 100 mL 2 molL﹣1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C. 反应C(s)+H2O(g) ![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,增加C的量 , 其反应速率增大
CO(g)+H2(g)在一可变容积的密闭容器中进行,增加C的量 , 其反应速率增大
D. 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率变慢:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g)的化学反应,能量关系如下图,下列叙述正确的是( )

A.该反应为吸热反应
B.1 mol锌的能量高于1 mol H2所含的能量
C.若将该反应设计成原电池,锌为负极
D.若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇脱氢可制取甲醛CH3OH(g)![]() HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。下列有关说法正确的是( )
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。下列有关说法正确的是( )

A. 脱氢反应的△H<0
B. 在t1K时,该反应的平衡常数为8.1
C. 600K时,Y点甲醇的υ(正) <υ(逆)
D. 若增大体系压强,曲线将向上平移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化合物是目前造成大气污染的主要气体,而汽车尾气中就含有NO 等多种污染气体。汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致。请结合所学知识回答下列问题:
(1) 已知:N2(g)+2O2(g)![]() 2NO2(g) △H1=+67.8 kJ/mol
2NO2(g) △H1=+67.8 kJ/mol
2NO2(g)![]() O2(g)+2NO(g) △H2=+116.2 kJ/mol
O2(g)+2NO(g) △H2=+116.2 kJ/mol
则N2(g)+O2(g)![]() 2NO(g) △H=_________kJ/mol;汽车启动后,气缸温度越高,单位时间内NO 的排放量越大,分析其原因为_____________
2NO(g) △H=_________kJ/mol;汽车启动后,气缸温度越高,单位时间内NO 的排放量越大,分析其原因为_____________
(2) 若反应N2(g)+O2(g)![]() 2NO(g)是在恒容条件下进行,下列能说明该反应已达到平衡状态的是________
2NO(g)是在恒容条件下进行,下列能说明该反应已达到平衡状态的是________
a.2υ正(N2)= υ逆(NO) b.混合气体密度不变
c.生成1molO2的同时生成2molNO d.混合气体平均相对分子质量不变
(3) 汽车尾气净化反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H= -746.5 kJ/mol,若将0.20molNO和0.10molCO充入一个容积恒定为1L 的密闭容器中,在不同条件下,反应过程中部分物质的浓度变化状况如图所示:
N2(g)+2CO2(g) △H= -746.5 kJ/mol,若将0.20molNO和0.10molCO充入一个容积恒定为1L 的密闭容器中,在不同条件下,反应过程中部分物质的浓度变化状况如图所示:
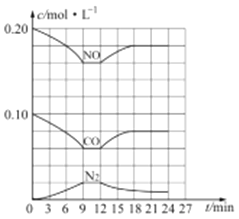
①该反应能自发进行的条件为_____ (填“高温”、“低温”或“任意温度”);
②在6~9 min 内,以CO 表示的平均反应速率 υ(CO)=________mol·L-l·min-1;
③第12min时改变的反应条件为_________ (填“升高温度”或“降低温度”);
④反应在第24min时的平衡常数K=____________(只列出计算式,无需计算结果),若保持温度不变,再向容器中充入CO、N2 各0.060mol,平衡将_________移动(填“正向”、“逆向”或“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以纯碱溶液为原料,通过电解的方法可制备小苏打,原理装置图如下:
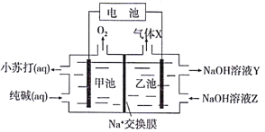
上述装置工作时,下列有关说法正确的是( )
A. 乙池电极接电池正极,气体X为H2
B. Na+由乙池穿过交换膜进入甲池
C. NaOH溶液Z比NaOH溶液Y浓度小
D. 甲池电极反应:4OH--4e-=2H2O+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。请回答下列问题:
(1)晒制蓝图时,用)K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3![]() ]2FeC2O4+3K2C2O4+2CO2↑:显色反应的化学反应式为___FeC2O4+___K3[Fe(CN)6]一___Fe3[Fe(CN)6]2+_______,配平并完成该显色反应的化学方程式。
]2FeC2O4+3K2C2O4+2CO2↑:显色反应的化学反应式为___FeC2O4+___K3[Fe(CN)6]一___Fe3[Fe(CN)6]2+_______,配平并完成该显色反应的化学方程式。
(2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。

①通入氮气的目的是_________________。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有______________,_____________。
③为防止倒吸,停止实验时应进行的操作是______________。
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是:______________。
(3)测定三草酸合铁酸钾中铁的含量。
①称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L-1KMnO4,溶液滴定至终点。在滴定管中装入KMnO4溶液的前一步,应进行的操作为____。滴定终点的现象是__________________。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为_____________________。若在滴定终点读取滴定管刻度时,俯视KMnO4溶液液面,则测定结果_____________________。
③过滤、洗涤实验操作过程需要的玻璃仪器有__________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com