
【题目】氮氧化合物是目前造成大气污染的主要气体,而汽车尾气中就含有NO 等多种污染气体。汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致。请结合所学知识回答下列问题:
(1) 已知:N2(g)+2O2(g)![]() 2NO2(g) △H1=+67.8 kJ/mol
2NO2(g) △H1=+67.8 kJ/mol
2NO2(g)![]() O2(g)+2NO(g) △H2=+116.2 kJ/mol
O2(g)+2NO(g) △H2=+116.2 kJ/mol
则N2(g)+O2(g)![]() 2NO(g) △H=_________kJ/mol;汽车启动后,气缸温度越高,单位时间内NO 的排放量越大,分析其原因为_____________
2NO(g) △H=_________kJ/mol;汽车启动后,气缸温度越高,单位时间内NO 的排放量越大,分析其原因为_____________
(2) 若反应N2(g)+O2(g)![]() 2NO(g)是在恒容条件下进行,下列能说明该反应已达到平衡状态的是________
2NO(g)是在恒容条件下进行,下列能说明该反应已达到平衡状态的是________
a.2υ正(N2)= υ逆(NO) b.混合气体密度不变
c.生成1molO2的同时生成2molNO d.混合气体平均相对分子质量不变
(3) 汽车尾气净化反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H= -746.5 kJ/mol,若将0.20molNO和0.10molCO充入一个容积恒定为1L 的密闭容器中,在不同条件下,反应过程中部分物质的浓度变化状况如图所示:
N2(g)+2CO2(g) △H= -746.5 kJ/mol,若将0.20molNO和0.10molCO充入一个容积恒定为1L 的密闭容器中,在不同条件下,反应过程中部分物质的浓度变化状况如图所示:
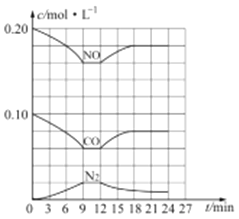
①该反应能自发进行的条件为_____ (填“高温”、“低温”或“任意温度”);
②在6~9 min 内,以CO 表示的平均反应速率 υ(CO)=________mol·L-l·min-1;
③第12min时改变的反应条件为_________ (填“升高温度”或“降低温度”);
④反应在第24min时的平衡常数K=____________(只列出计算式,无需计算结果),若保持温度不变,再向容器中充入CO、N2 各0.060mol,平衡将_________移动(填“正向”、“逆向”或“不”)。
【答案】 +184.0 温度升高,反应速率加快;且温度升高有利于平衡正向移动 ac 低温 0.0067 升高温度 ![]() 逆向
逆向
【解析】试题分析:本题考查盖斯定律的应用、化学平衡的标志、化学平衡图像的分析、外界条件对化学反应速率和化学平衡的影响、化学反应速率和化学平衡常数的计算、化学反应自发性的判断。
(1)对反应编号,N2(g)+2O2(g)![]() 2NO2(g)△H1=+67.8kJ/mol(①式)
2NO2(g)△H1=+67.8kJ/mol(①式)
2NO2(g)![]() O2(g)+2NO(g)△H2=+116.2kJ/mol(②式)
O2(g)+2NO(g)△H2=+116.2kJ/mol(②式)
应用盖斯定律,将①式+②式得,N2(g)+O2(g)![]() 2NO(g)△H=ΔH1+ΔH2=(+67.8kJ/mol)+(+116.2kJ/mol)=+184.0kJ/mol。汽车启动后,气缸温度越高,单位时间内NO的排放量越大,其原因是:温度升高,反应速率加快;且温度升高有利于平衡正向移动。
2NO(g)△H=ΔH1+ΔH2=(+67.8kJ/mol)+(+116.2kJ/mol)=+184.0kJ/mol。汽车启动后,气缸温度越高,单位时间内NO的排放量越大,其原因是:温度升高,反应速率加快;且温度升高有利于平衡正向移动。
(2)a项,2υ正(N2)=υ逆(NO)表示正、逆反应速率相等,能说明反应已达到平衡状态;b项,根据质量守恒定律,混合气体的总质量始终不变,在恒容容器中,混合气体的密度始终不变,混合气体的密度不变不能说明反应已达到平衡状态;c项,生成1molO2一定消耗2molNO,生成1molO2的同时生成2molNO,说明各物质的浓度保持不变,能说明反应已达到平衡状态;d项,根据质量守恒定律,混合气体的总质量始终不变,该反应反应前后气体分子数不变,建立平衡过程中气体分子总物质的量始终不变,混合气体平均相对分子质量始终不变,混合气体平均相对分子质量不变不能说明反应已达到平衡状态;能说明反应已达到平衡状态的是ac,答案选ac。
(3)①反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g)的ΔH=-746.5kJ/mol
N2(g)+2CO2(g)的ΔH=-746.5kJ/mol![]() 0、ΔS
0、ΔS![]() 0,该反应能自发进行时ΔG=ΔH-TΔS
0,该反应能自发进行时ΔG=ΔH-TΔS![]() 0,可见该反应自发进行的条件为低温。
0,可见该反应自发进行的条件为低温。
②根据图像6~9min内,υ(CO)=![]() =0.0067mol/(L·min)。
=0.0067mol/(L·min)。
③根据图像,第12min时改变条件,达到新平衡时N2浓度减小,NO、CO的浓度增大,改变条件平衡向逆反应方向移动,由于该反应的正反应为放热反应,所以改变的条件为升高温度。
④根据图像,结合三段式
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
c(起始)(mol/L) 0.2 0.1 0 0
c(转化)(mol/L) 0.02 0.02 0.01 0.02
c(24min)(mol/L) 0.18 0.08 0.01 0.02
24min时反应达到平衡状态,反应的平衡常数K=![]() =
=![]() =0.01929。若保持温度不变,再向容器中充入CO、N2各0.060mol,此时NO、CO、N2、CO2物质的量浓度依次为0.18mol/L、0.14mol/L、0.07mol/L、0.02mol/L,此时的浓度商Qc=
=0.01929。若保持温度不变,再向容器中充入CO、N2各0.060mol,此时NO、CO、N2、CO2物质的量浓度依次为0.18mol/L、0.14mol/L、0.07mol/L、0.02mol/L,此时的浓度商Qc=![]() =0.044
=0.044![]() 0.01929,平衡将逆向移动。
0.01929,平衡将逆向移动。


科目:高中化学 来源: 题型:
【题目】给你提供纯锌、纯铜片和500 mL 0.4 mol·L-1的H2SO4溶液、导线、1000 mL量筒。试用下图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量。

(1)如图所示,装置气密性良好,且1 000 mL量筒中已充满了水,则开始实验时,首先要______。
(2)a电极材料为________,其电极反应式为______________。b电极材料为________,其电极反应式为______________。
(3) 当量筒中收集672 mL气体时(已折算到标准状况下),通过导线的电子的物质的量为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据实验室制备氯气的装置(如下),回答下列问题;

(1)仪器A 和 B名称___________ ;____________
(2)写出B中发生反应的离子方程式_____________________________________
(3)装置C的作用__________________________________________
(4)装置D的作用________________________________________________
(5)检验E中氯气已经收集满的方法_________________________________________
(6)写出F中发生的反应方程式______________________________________________
(7)每生成0.5mol氯气转移________________个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Co(H2PO2)2广泛用于化学镀钴,以金属Co和NaH2PO2为原料,采用四室电渗析槽电解法制备,原理如图。下列叙述正确的是

A. b为阳离子交换膜
B. 通电后原料室的H2PO2向产品室迁移,阴极区溶液pH增大
C. 石墨电极反应为4OH4e![]() O2↑+2H2O
O2↑+2H2O
D. 当产生1 mol Co(H2PO2)2时,产生标准状况下气体11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,0.01mol/L的这四种溶液pH与该元素原子半径的关系如下图所示。下列说法正确的是

A. 简单离子半径: X>Y>Z>W
B. W的单质在常温下是黄绿色气体
C. 气态氢化物的稳定性: Z>W>Y
D. X和Y的最高价氧化物对应的水化物恰好中和时,溶液中的微粒共有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Hf元素有多种核素,其中Hf是一种新合成的核素。下列关于![]() 的叙述中不正确的是( )
的叙述中不正确的是( )
A.该核素的质子数是72B.该核素的中子数是113
C.该核素的核外电子数是72D.该元素的相对原子质量是185
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W、R在元素周期表中的相对位置如图所示,其中R元素的常见单质为气体,下列判断不正确的是( )

A.原子半径:Z>X> Y
B.非金属性:R>W> Z
C.X、Z对应的含氧酸均为强酸
D.Y的最简单氢化物的沸点比X的高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)钠米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂。工业上二氧化钛的制备是:
资料卡片 | ||
物质 | 熔点 | 沸点 |
SiCl4 | -70℃ | 57.6℃ |
TiCl4 | -25℃ | 136.5℃ |
I. 将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应制得混有SiCl4杂质的TiCl4。
II. 将SiCl4分离,得到纯净的TiCl4。
III. 在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O。
IV. TiO2·xH 2O高温分解得到TiO2。
①TiCl4与SiCl4在常温下的状态是________。II中所采取的操作名称是_______。
②III中反应的化学方程式是____________________________________________。
③如IV在实验室完成,应将TiO2·xH2O放在________(填仪器编号)中加热。

(2)根据废水中所含有害物质的不同,工业上有多种废水的处理方法。

①废水I若采用CO2处理,离子方程式是________________。
②废水Ⅱ常用明矾处理。实践中发现废水中的c(HCO![]() )越大,净水效果越好,这是因为______________。
)越大,净水效果越好,这是因为______________。
③废水III中的汞元素存在如下转化(在空格上填相应的化学式):Hg2++______=CH3Hg++H+,我国规定,Hg2+的排放标准不能超过0.05 mg/L。若某工厂排放的废水1 L中含Hg2+ 3×10-7mo1,是否达到了排放标准__(填“是”或“否”)。
④废水Ⅳ常用C12氧化CN—成CO2和N2,若参加反应的C12 与CN-的物质的量之比为5︰2,则该反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。

回答下列问题:
(1)写出制取乙酸乙酯的化学反应方程式_______________________________。
(2)浓硫酸的作用是___________________与吸水剂。
(3)饱和碳酸钠溶液的主要作用是_________________________________________________。
(4)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止__________________。
(5)若要把制得的乙酸乙酯分离出来,应采用的实验操作是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com