
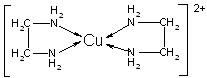
| A.配位键 | B.极性键 | C.离子键 | D.非极性键 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:填空题
 )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
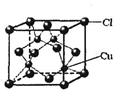
 和
和 代表两种不同的粒子。E与D形成的化合物的晶胞是下列中的 (填序号),在该晶胞中阳离子的配位数为 。
代表两种不同的粒子。E与D形成的化合物的晶胞是下列中的 (填序号),在该晶胞中阳离子的配位数为 。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
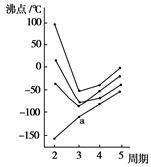
| A.H2S | B.HCl | C.PH3 | D.SiH4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.氧原子的杂化类型发生了改变 | B.微粒的形状发生了改变 |
| C.微粒的化学性质发生了改变 | D.微粒中的键角发生了改变 |


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 键和1个大
键和1个大 键,C2H2是非极性分子
键,C2H2是非极性分子
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.附着在试管内壁上的AgCl固体可用氨水溶解而洗去 |
| B.可用氨水鉴别AlCl3、AgNO3和CuSO4三种溶液 |
| C.向氨水中滴加CuSO4溶液至过量,先产生蓝色沉淀,然后沉淀溶解并得到深蓝色溶液 |
| D.加热碘单质,产生紫色碘蒸气,这个过程只克服范德华作用力 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.离子化合物熔沸点较高、共价化合物熔沸点较低 |
| B.非金属原子间不可能形成离子化合物 |
| C.确定某化合物为离子化合物,可以用融化时能否导电来判断 |
| D.共价化合物中可能有离子键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com