
【题目】有机物A与B的分子式为C5H10O2,在酸性条件下均可水解,转化关系如图。下列有关说法中正确的是( )
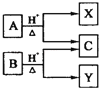
A.X、Y互为同系物
B.C分子中的碳原子数最多为3个
C.X、Y的化学性质不可能相似
D.X、Y互为同分异构体
【答案】D
【解析】
分子式为C5H10O2的A和B都能发生水解,说明两者都是酯。且能生成同一产物C,说明X和Y分子式相同,但不是同一物质,互为同分异构体。若C是酸,则X和Y都是醇;若C是醇,则X和Y都是酸;据以上分析解答。
A项,X、Y互为同分异构体,分子式相同,结构不相似,不是同系物,故A项错误;
B项,因X、Y互为同分异构体,若C是酸,X、Y是醇,至少3个C原子以上的醇才能形成同分异构体,则C的碳原子数最多为2个;若C是醇,X、Y是羧酸,至少4个C原子以上的羧酸才能形成同分异构体,则C的碳原子数最多为1个,故B项错误;
C项,X、Y均为酸或醇,属于同一类物质,化学性质相似,故C项错误;
D项,根据分析可知X、Y互为同分异构体,故D项正确;
综上所述,本题正确答案为D。


科目:高中化学 来源: 题型:
【题目】已知充分燃烧a g乙炔气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是
A. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);△H=+b kJ/mol
B. C2H2(g)+![]() O2(g)=2CO2(g)+H2O(l);△H=+2b kJ/mol
O2(g)=2CO2(g)+H2O(l);△H=+2b kJ/mol
C. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);△H=-2b kJ/mol
D. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);△H=-4b kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.激素类药物乙烯雌酚的结构简式为: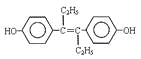 ,它的分子式是:C18H20O2
,它的分子式是:C18H20O2
B.等质量的甲烷、乙烯、乙醇分别充分燃烧,所耗用氧气的量依次减少
C.聚乳酸(![]() )是由单体之间通过加聚反应合成的
)是由单体之间通过加聚反应合成的
D.实验证实![]() 可使溴的四氯化碳溶液褪色,说明该分子中存在碳碳双键
可使溴的四氯化碳溶液褪色,说明该分子中存在碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关Na2CO3和NaHCO3的性质说法正确的是
A. 溶解度:Na2CO3>NaHCO3
B. 右图所示装置可证明稳定性:Na2CO3>NaHCO3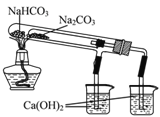
C. 用澄清石灰水可鉴别Na2CO3溶液和NaHCO3溶液
D. 等质量的Na2CO3和NaHCO3分别与过量盐酸反应,放CO2质量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO具有还原性,不与碱反应,可以被过氧化钠吸收。某化学兴趣小组为了研究NO与Na2O2反应,通过如图所示装置进行实验。
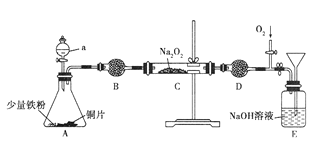
(1)仪器B的名称是_________________,其中填充的是___________________,作用为___________________________________________________________。
(2)从分液漏斗中加稀硝酸之前,先加入少量稀硫酸,目的是__________________。
(3)实验观察到C中固体颜色变白,该兴趣小组通过进一步实验证明C中生成的白色固体为NaNO2, C中反应的化学方程式为_______________________________。
(4)实验开始后需打开活塞,通入氧气,E中观察到的主要现象为_______________;NaOH溶液的作用是____________________________,若最终E中溶液只有一种溶质,发生的总反应方程式是___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备乙酸乙酯的绿色合成路线之一为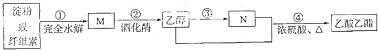 :下列说法正确的是( )
:下列说法正确的是( )
A.M的分子式为![]() B.淀粉与纤维素互为同分异构体
B.淀粉与纤维素互为同分异构体
C.![]() 的反应类型属于取代反应D.N的结构简式为
的反应类型属于取代反应D.N的结构简式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁用于照明弹,是因为镁能在空气中燃烧产生耀眼光芒,并发生如下三个反应:
①2Mg+O2![]() 2MgO
2MgO
②3Mg+N2![]() Mg3N2
Mg3N2
③2Mg+CO2![]() 2MgO+C(黑色)。
2MgO+C(黑色)。
关于上述三个反应的叙述不正确的是( )
A.反应①②③的还原剂都是金属镁
B.反应①和③中都是氧元素被还原
C.反应②的生成物中氮元素为-3价
D.反应③的氧化剂是二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸铁锂电池是新型的绿色能源电池,其简化的生产工艺流程如下。
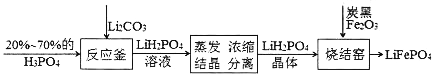
(1)反应釜中反应的化学方程式为_______,该反应体现出非金属性关系:P_____C(填“>”或“<”)。
(2)室温下,LiH2PO4溶液的pH随c(H2PO4-)的变化如图1所示,H3PO4溶液中H2PO4-的分布分数![]() 随pH的变化如图2所示[
随pH的变化如图2所示[![]() (含P元素的粒子)]。
(含P元素的粒子)]。
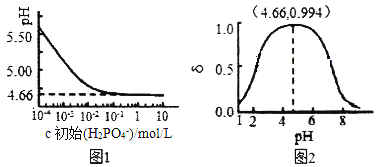
①由图1知,低浓度时LiH2PO4溶液的pH小于7,且随着c初始(H2PO4-)的增大而减小,其合理的解释为__________________。
②综合上图分析,若用浓度大于1mol/L的H3PO4溶液溶解Li2CO3,要使反应釜中的H3PO4几乎全部转化成LiH2PO4,反应釜中需要控制溶液的pH=________。
(3)磷酸铁锂电池总反应为:LiFePO4+6C![]() Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,Li+移向______(填“阳极”或“阴极”);放电时,正极反应式为__________________。
Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,Li+移向______(填“阳极”或“阴极”);放电时,正极反应式为__________________。
(4)磷酸铁锂电池中铁的含量可通过如下方法测定:称取1.60g试样用盐酸溶解,在溶液中加入稍过量的SnCl2溶液,再加入HgCl2饱和溶液,用二苯胺磺酸钠作指示剂,用0.030mol/L重铬酸钾溶液滴定至溶液由浅绿色变为蓝紫色,消耗重铬酸钾溶液50.00mL。
已知:2Fe3++Sn2++6Cl-=SnCl62-+2Fe2+
4Cl-+Sn2++2HgCl2=SnCl62-+Hg2Cl2
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
①实验中加入HgCl2饱和溶液的目的是____________。
②铁的百分含量Fe(%)=_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应mA(s)+nB(g)![]() cC(g)+fD(g)反应过程中,当其它条件不变时,C的体积分数(C%)与温度(T)和压强(P)的关系如图所示(T2>T1),下列叙述正确的是( )
cC(g)+fD(g)反应过程中,当其它条件不变时,C的体积分数(C%)与温度(T)和压强(P)的关系如图所示(T2>T1),下列叙述正确的是( )

A.达到平衡后,若使用催化剂,C的体积分数增大
B.达到平衡后,若使温度升高,化学平衡向逆反应方向移动
C.化学方程式中n>c+f
D.达到化学平衡后,增加A的量有利于化学平衡向正反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com