
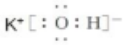 .
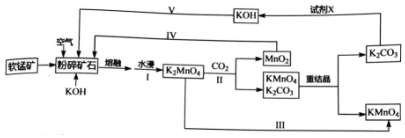
.分析 软锰矿的主要成分为MnO2,由工艺流程转化关系可知,MnO2、KOH的熔融混合物中通入空气时发生反应生成K2MnO4,向K2MnO4溶液中通入CO2制备KMnO4、还生成K2CO3、MnO2,通过过滤,分离出二氧化锰,滤液中含KMnO4和K2CO3,根据KMnO4和K2CO3在溶解性上不同采用蒸发结晶的方式可分离出高锰酸钾和碳酸钾,对粗高锰酸钾进行重结晶、干燥得到纯净的高锰酸钾;向碳酸钾溶液中加入石灰生成碳酸钙和氢氧化钾,据此分析.
解答 解:(1)KOH为离子化合物,由钾离子和氢氧根离子构成,氢氧化钾的电子式为: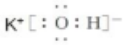 ;
;
故答案为: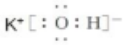 ;
;
(2)由工艺流程转化关系可知,MnO2、KOH的熔融混合物中通入空气时发生反应生成K2MnO4,根据元素守恒还应生成水.反应中锰元素由+4价升高为+6价,总升高2价,氧元素由0价降低为-2价,总共降低4价,化合价升降最小公倍数为4,所以MnO2系数2,O2系数为1,根据锰元素守恒确定K2MnO4系数为2,根据钾元素守恒确定KOH系数为4,根据氢元素守恒确定H2O系数为2,所以反应化学方程式为:2MnO2+4KOH+O2$\frac{\underline{\;熔融\;}}{\;}$2K2MnO4+2H2O;
故答案为:2MnO2+4KOH+O2$\frac{\underline{\;熔融\;}}{\;}$2K2MnO4+2H2O;
(3)试剂X是将碳酸钾反应生成氢氧化钾,所以从经济性考虑试剂X宜选择石灰乳(或生石灰),上述流程中,步骤IV和V都是物质循环利用,其目的是循环利用二氧化锰、氢氧化钾,提高原料利用率;
故答案为:石灰乳(或生石灰);循环利用二氧化锰、氢氧化钾,提高原料利用率;
(4)pH=10时c(OH-)=10-4mol/L,根据Ksp[Mn(OH)2]=c2(OH-)×c(Mn2+)可知,溶液中c(Mn2)=$\frac{2.0×1{0}^{-13}}{(1{0}^{-4})^{2}}$=2.0×10-5mol•L-1;
故答案为:2.0×10-5mol•L-1;
(5)用高锰酸钾溶液滴定硫酸锰溶液,产生黑色沉淀,高锰酸根离子与锰离子发生价态归中反应,发生反应的离子方程式为2MnO4-?+3Mn2++2H2O=5MnO2↓+4H+;
故答案为:2MnO4-+3Mn2++2H2O=5MnO2↓+4H+;
(6)电解锰酸钾溶液时,阳极上锰酸根离子失电子生成高锰酸根离子,电极反应式为MnO42--e-=MnO4-,阴极上水得电子生成氢气和氢氧根离子,电极反应为2H2O+2e-=H2↑+2OH-,则阴极溶液的pH增大;
故答案为:①MnO42--e-=MnO4-②增大.
点评 本题考查常见氧化剂与还原剂、氧化还原反应、化学计算和对工艺流程的理解、阅读题目获取信息的能力等,难度中等,需要学生具有扎实的基础知识与灵活运用知识解决问题的能力.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 mol O2中含有1.204×1024个氧原子,在标准状况下占有体积22.4 L | |
| B. | 1 mol O3和1.5 mol O2含有相等的氧原子数 | |
| C. | 等体积、浓度均为1 mol•L-1的磷酸溶液和盐酸,含有的氢元素质量之比为3:1 | |
| D. | 等物质的量的干冰和葡萄糖(C6H12O6)中所含的碳原子数之比为1:6,氧原子数之比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -332 | B. | +130 | C. | +332 | D. | -l30 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol NH4+ 所含质子数为10NA | |
| B. | 10克氖气所含原子数约为6.02×1023 | |
| C. | 常温常压下,22.4 L SO2所含的分子数为NA | |
| D. | 常温常压下,32 g O2和O3的混合气体所含原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,5.6L二氧化碳气体中含有的氧原子数为0.5NA | |
| B. | 0.1L0.5mol/LCH3COOH溶液中含有的氢离子数为0.05NA | |
| C. | 1molFe溶于过量硝酸,电子转移数为2NA | |
| D. | 标准状况下,2.24LCC14含有的共价键数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com