
����Ŀ����֪1��2�������鳣����Ϊ��ɫҺ�壬�е�83.5�棬�ܶ�1.23g/mL��������ˮ�������ڴ����ѡ���ͪ���л��ܼ����Ҵ��ķе�Ϊ78.5�森ij��ѧ����С��Ϊ̽��1��2�����������ȥ��Ӧ�����������ʵ��װ�ã���ش��������⣮ 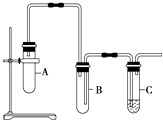
��1����ش���μ��װ��������
��2����װ��A�д��Թ����ȼ���1��2���������NaOH���Ҵ���Һ���ټ������Ƭ��Ŀ���� �� ����װ��C���Թ����������ϡ��ˮ��
��3��Ϊ��ʹ��Ӧ��75�����ҽ��У����õķ����� ��
��4����װ��A�д��Թ������ӵij������ܵ������� �� װ��B�������� ��
��5��֤��1��2���������ѷ�����ȥ��Ӧ�������� �� װ��A��C�з�����Ӧ�Ļ�ѧ����ʽΪװ��A�� װ��C ��
���𰸡�
��1����������ĩ�˲���ʢˮ���ձ��У��þƾ��Ƽ��ȣ��������棩װ��A�д��Թܣ���������ĩ�������ݳ��֣����ƿ��ƾ��ƣ����ɿ��֣�һ������������г���һ��ˮ������֤����©��
��2����ֹ����
��3����װ��A�д��Թܷ���75�����ҵ�ˮԡ�м���
��4����������������ֹ����
��5����ˮ��ɫ��CH2ClCH2Cl+NaOH ![]() CHCl=CH2��+NaCl+H2O��CH2ClCH2Cl+2NaOH
CHCl=CH2��+NaCl+H2O��CH2ClCH2Cl+2NaOH ![]() CH��CH��+2NaCl+2H2O��CHCl=CH2+Br2��CHClBrCH2Br��CH��CH+Br2��CHBr�TCHBr��CH��CH+2Br2��CHBr2CHBr2
CH��CH��+2NaCl+2H2O��CHCl=CH2+Br2��CHClBrCH2Br��CH��CH+Br2��CHBr�TCHBr��CH��CH+2Br2��CHBr2CHBr2
���������⣺��1.���跨ʹװ�������γ���ѹ���������Լ��ij����ֶΣ������Ӻ�װ�ú�������ĩ�˲���ʢˮ���ձ��У��þƾ��Ƽ��ȣ��������棩װ��A�д��Թܣ���������������ͣ���������ĩ�������ݳ��֣����ƿ��ƾ��ƣ����ɿ��֣�һ������������г���һ��ˮ������֤����©�������Դ��ǣ���������ĩ�˲���ʢˮ���ձ��У��þƾ��Ƽ��ȣ��������棩װ��A�д��Թܣ���������ĩ�������ݳ��֣����ƿ��ƾ��ƣ����ɿ��֣�һ������������г���һ��ˮ������֤����©����
��2.��1��2�������鳣����Ϊ��ɫҺ�壬�е�83.5�棬�Ҵ��ķе�Ϊ78.5�棬1��2���������NaOH���Ҵ���Һ��Ӧ����Ӧ��е�ͣ�Ϊ��ֹ���У���ӷ�ʯ�����Դ��ǣ���ֹ���У�
��3.����Ϊˮ�ķе���100�棬��ˮԡ���ȵ��¶Ȳ����ܳ���100�棬ˮԡ���ȵ��¶���ʹ��Ӧ�������Լ������¶Ⱦ��ȣ����ڿ��Ʒ�Ӧ���¶ȣ�Ϊ��ʹ��Ӧ��75�����ҽ��У����õķ����ǽ�װ��A�д��Թܷ���75�����ҵ�ˮԡ�м��ȣ����Դ��ǣ���װ��A�д��Թܷ���75�����ҵ�ˮԡ�м��ȣ�
��4.��Aװ����1��2���������顢�Ҵ��е�ͣ��ӷ�����װ��A�д��Թ������ӵij������ܳ������������ã��������������������ã�װ��A�з�����ȥ��Ӧ���ɺ��в����ͼ����л��������巢���ӳɷ�Ӧ��װ��B�ܷ�ֹC�е�Һ�嵹����A�У�������������ã����Դ��ǣ���������������ֹ������
��5.��1��2���������ѷ�����ȥ��Ӧ�����ɺ��в����ͼ����л��������巢���ӳɷ�Ӧ����ˮ��ɫ��װ��A�У�1��2�������������������ƴ���Һ���ܷ�����ȥ��Ӧ��������ϩ�����Ȼ��ƺ�ˮ������ʽΪ��CH2ClCH2Cl+NaOH ![]() CHCl=CH2��+NaCl+H2O��CH2ClCH2Cl+2NaOH
CHCl=CH2��+NaCl+H2O��CH2ClCH2Cl+2NaOH ![]() CH��CH��+2NaCl+2H2O��
CH��CH��+2NaCl+2H2O��
װ��C�У�����ϩ����̼̼˫����������ˮ�����ӳɷ�Ӧ����ˮ��ɫ����Ӧ�ķ���ʽΪCHCl=CH2+Br2��CHClBrCH2Br��CH��CH+Br2��CHBr�TCHBr��CH��CH+2Br2��CHBr2CHBr2 �� ���Դ��ǣ���ˮ��ɫ��CH2ClCH2Cl+NaOH ![]() CHCl=CH2��+NaCl+H2O��CH2ClCH2Cl+2NaOH
CHCl=CH2��+NaCl+H2O��CH2ClCH2Cl+2NaOH ![]() CH��CH��+2NaCl+2H2O��CHCl=CH2+Br2��CHClBrCH2Br��CH��CH+Br2��CHBr�TCHBr��CH��CH+2Br2��CHBr2CHBr2��
CH��CH��+2NaCl+2H2O��CHCl=CH2+Br2��CHClBrCH2Br��CH��CH+Br2��CHBr�TCHBr��CH��CH+2Br2��CHBr2CHBr2��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ����
A. �����ʵ�����NO��NO2ͬʱ��NaOH��Һ���գ�NO + NO2 +2OH��= 2NO2��+H2O
B. �����ʵ�����MgCl2��Ba��OH��2�� HCl ��Һ��ϣ�Mg2++3OH��+H+=Mg��OH��2��+H2O
C. Ǧ���س��ʱ��������Ӧ��PbSO4+2H2O��2e��=PbO2+4H++SO42��
D. �Խ�����Ϊ������ⱥ��NaCl��Һ��2Cl��+2H2O![]() H2��+Cl2��+2OH��
H2��+Cl2��+2OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��ͨ��״̬�£���100mL����Ͳ�����80mL���������۲���Ͳ���������______�����������о���ȼ�յIJ�����ˮ��Һ�еĵ��뷽��ʽ��______________________________________
��2�����ֹ�������ˮ������ɱ����Ϊ���ƴ��ģ��Ⱦ�Լ�����������Ч����֮һ��Ư���dz��õ�������
�ٹ�ҵ�Ͻ�����ͨ��ʯ����[Ca(OH)2]��ȡƯ�ۣ���ѧ��Ӧ����ʽΪ___________________
��Ư�۵���Ҫ�ɷ��ǣ��ѧʽ��____________
��3����д��һ���ʺ�ʵ�����Ʊ������ķ�Ӧ����ʽ��__________________________________���÷�Ӧ������1.00mol��ԭ��������������________g����������ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��0.1molij������������ȫȼ�գ���������ȫ��ͨ��Ũ�����У�Ũ��������9g������ͨ�������ij���ʯ��ˮ�У��õ�����50g��
��1�����л�������ķ���ʽ
��2����������ֻ�������������ڲ���������д����ṹ��ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�п��ܺ���K+��NH4+��Ba2+��Mg2+��Ag+��OH����SO42����CO32���е�ij���֣����ø���Һ������ʵ�飺��ȡ����Һ������������������������������ȡ������������Ũ����������Һ���а�ɫ�������ɣ��۽����г������ˣ�ȡ��Һ�ȣ�����ɫ�̼�����ζ����ų�����������ʹʪ��ĺ�ɫʯ����ֽ������
��1���ɴ��ƶϣ�����Һ�п϶���_______________���ӣ��϶���__________________���ӣ�
��2��д���۷�Ӧ�Ļ�ѧ����ʽ___________________________________________________��
��3������ȷ���Ƿ���ڵ�������________________�������ʵ�鷽���ǣ���дʵ�����ƺ۲쵽������Ҫ��дʵ��������̣�_________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȥþ���л��е��������ۣ���ѡ�õ��Լ����� ��
A. ϡ���� B. ϡ���� C. ����������Һ D. ��ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ö���ȩ��ʳƷ�뻯ױƷ��ҵ�е��������Ӽ�����ҵ�Ͽ�ͨ���л�����ԭ��A�Ƶã���ϳ�·����ͼ��ʾ�� 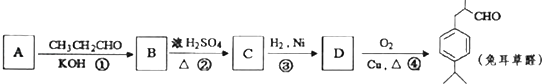
��֪����CH3CHO+CH3CH0 ![]() CH3CH��OH��CH2CHO
CH3CH��OH��CH2CHO
�� ![]() ���
��� ![]()
��ش�
��1��B�к��������ŵ������� ��
��2�������ϳ�·���з�Ӧ����������Ӧ����������д��Ӧ���ͣ���
��3��д����D����ö���ȩ�Ļ�ѧ��Ӧ����ʽ ��
��4��A��ͬ���칹���з����������������֣�
a����ʹFeCl3��Һ����ɫ
b���ܷ����Ӿ۷�Ӧ
c��������ֻ��������Ϊ��λ��ȡ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Fe �� Fe2O3 �Ļ���ﹲ 27.2g������ 200mL ϡ H2SO4���ڱ�״�����ռ��� 2.24LH2��Fe�� Fe2O3 ����ʣ�ࡣΪ�к����� H2SO4����ʹ Fe Ԫ��ȫ��ת��Ϊ Fe(OH)2 ������������ 400mL 3mol/L �� NaOH ��Һ����� H2SO4 �����ʵ���Ũ��Ϊ
A. 3mol/L B. 2.25mol/L C. 2mol/L D. 0.5mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ϊԭ�ϣ�ͨ��̼�Ȼ�ԭ���ɺϳɵ�������AlN����ͨ����ⷨ����ȡ���������ʱ����������CO2��ͨ��������̼���黯�����ã�
��ش�
��1����֪��2Al2O3��s���T4Al��g��+3O2��g����H1=3351KJmol��1
2C��s��+O2��g���T2CO��g����H2=��221KJmol��1
2Al��g��+N2��g���T2AlN��s����H3=��318KJmol��1
̼�Ȼ�ԭAl2O3�ϳ�AlN�����Ȼ�ѧ����ʽ��___________________________��
��2���ڳ�ѹ��Ru/TiO2���£�CO2��H2������壨�����1��4�������ʵ���a mol�����з�Ӧ�����CO2ת���ʡ�CH4��COѡ�������¶ȱ仯����ֱ���ͼ1��ͼ2��ʾ��ѡ���ԣ�ת����CO2������CH4��CO�İٷֱȣ���
��Ӧ��CO2��g��+4H2��g��![]() CH4��g��+2H2O��g����H4
CH4��g��+2H2O��g����H4
��Ӧ��CO2��g��+H2��g��![]() CO��g��+H2O��g����H5
CO��g��+H2O��g����H5
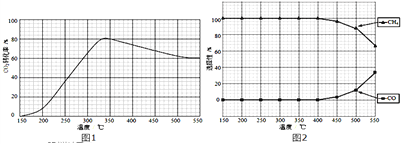
������˵������ȷ����_______
A����H4����
B���¶ȿ�Ӱ������ѡ����
C��CO2ƽ��ת�������¶���������������
D�������������䣬��CO2��H2�ij�ʼ����ȸı�Ϊ1��3�������CO2ƽ��ת����
��350��ʱ����Ӧ����t1ʱ�̴ﵽƽ�⣬ƽ��ʱ�������ΪVL���¶��·�Ӧ���ƽ�ⳣ��Ϊ______����a��V��ʾ��
��350����CH4���ʵ�����ʱ��ı仯������ͼ3��ʾ������400����0��t1ʱ��CH4���ʵ�����ʱ��ı仯����_______��
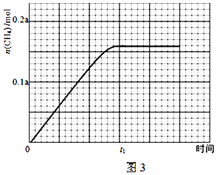
��3�������ױ�����CO2�����ڼ���ˮ��Һ�е�����ɼ��飬���ɼ���ĵ缫��Ӧʽ��_______��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com