
| A. | 碘单质受热易升华,用加热法可以分离高锰酸钾和碘单质的混合物 | |
| B. | 分液时,分液漏斗内的上下层液体应分别都从下口放出 | |
| C. | 向溴水中加入苯,充分振荡后静置,上层无色,下层橙红色 | |
| D. | 配制100 g10%的CuSO4溶液,称取10 g硫酸铜固体溶于90 g水中 |
分析 A.加热时高锰酸钾易分解;
B.分液时应避免液体重新混合而污染;
C.苯的密度比水小;
D.配制100 g10%的CuSO4溶液,溶质质量为10g,溶液质量为100g.
解答 解:A.加热时高锰酸钾易分解,不能直接用加热的方法分离,故A错误;
B.分液时应避免液体重新混合而污染,上层液体从上口倒出,下层液体从下端流出,故B错误;
C.苯的密度比水小,上层液体呈橙红色,故C错误;
D.配制100 g10%的CuSO4溶液,溶质质量为10g,溶液质量为100g,则可称取10 g硫酸铜固体溶于90 g水中,故D正确.
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及实验基本操作、物质的性质等知识点,明确实验原理及物质性质是解本题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 胶体与其他分散系最本质的区别是分散质粒子的直径介于1-100 nm之间 | |
| B. | 胶体和溶液都一定是均一透明的分散系,可以用丁达尔效应来鉴别 | |
| C. | 制备Fe(OH)3胶体的操作为,在沸水中逐滴滴加5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色沉淀,停止加热 | |
| D. | 用过滤的方法可以将胶体和溶液分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
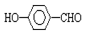 的沸点比
的沸点比 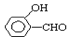 高,原因是:
高,原因是: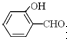 形成分子内氢键,而
形成分子内氢键,而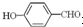 形成分子间氢键,分子间氢键使分子间作用力增大.
形成分子间氢键,分子间氢键使分子间作用力增大.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X一定为电解质 | B. | X可能为NaCl | ||
| C. | X不能是酸类 | D. | X可以是任何化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,0.1mol/LHA溶液的pH=1 | B. | 0.1mol/LHA溶液中:c(HA)>c(A-) | ||
| C. | ①溶液中:c(HA)+c(A-)=0.1mol/L | D. | ①溶液中:c(A-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 480mL | B. | 1000mL | C. | 100mL | D. | 500mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高分子分离膜应用于食品工业中,可用于浓缩天然果汁、乳制品加工、酿酒业等 | |
| B. | 合成高分子材料制成的人工器官一般都受到人体的排斥作用,难以达到生物相容的程度 | |
| C. | 复合材料一般是以一种材料作为基体,另一种材料作为增强剂 | |
| D. | 导电塑料是应用于电子工业的一种新型有机高分子材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2S的摩尔质量为160 | |
| B. | 每生产1molCu需转移2mol电子 | |
| C. | 该反应中Cu2S既是氧化剂又是还原剂 | |
| D. | 若用该反应生产铜,全世界每年产生的SO2的体积为1.4×106L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com